Identification de la substance active du déserbant.
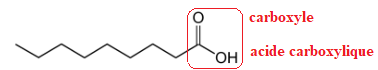
On donne la formule topologique de la molécule d'acide pélargonique ou acide nonanoïque.
Q1 - Ecrire la formule semi-développée de cet acide, entourer le groupe caractéristique, nommer la famille fonctionnelle.
H
3C-(CH
2)
7-COOH.
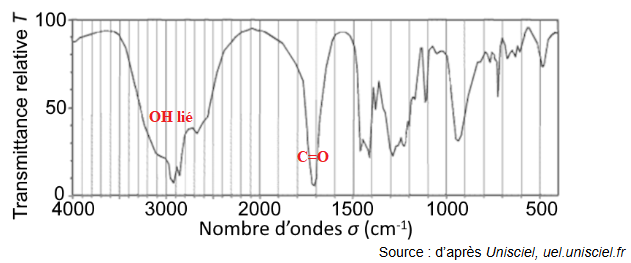
On donne le spectre IR de l'échantillon.
Q2- Justifier que ce spectre peut correspondre à celui de l'acide nonanoïque.
.
2. Dosage de l'espèce chimique active du désherbant .
Sur l'étiquette on lit 250 g / L d'acide pélargonique.
La solution commerciale est diluée 10 fois. La solution diluée est notée S. On prélève V
A = 10,0 mL de S que l'on titre par une solution de soude de concentration Cb = 0,100 mol / L.
Q3. Indfiiquer la verrerie pour effectuer la dilution.
Fiole jaugée de 100,0 mL ; pipette jaugée de 10,0 mL ; becher ; pissette d'eau distillée.
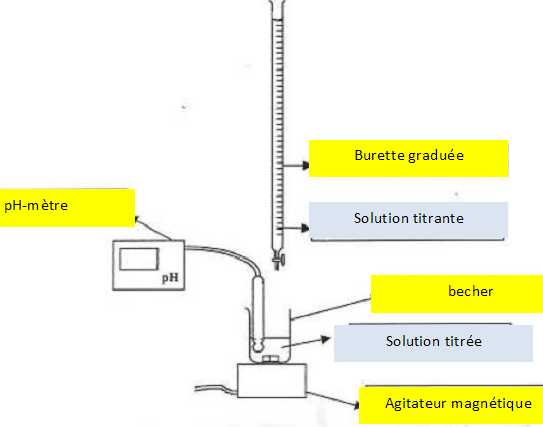
Q4. Réaliser un schéma d'un dispositif de titrage pHmétrique.
 Q5.
Q5. Ecrire l'équation de la réaction support du titrage. L'acide sera noté R-COOH.
RCOOH aq + HO
-aq --> RCOO
-aq + H
2O(l).
Q6.
Sélectionner parmi les termes suivants, la ou les qualités que doit
posséder la réaction support du titrage : lente, rapide, unique,
multiple, totale, non-totale.
Réaction rapide, unique et totale.
Q7. Définir l'équivalence d'un titrage.
A l'équivalence d'un tiitrage, les quantités de matière des réactifs sont en proportions stoechiométriques.
Q8. Vérifier que la concentration en masse d'acide nonanoïque indiquée est compatible avec le résultat du dosage.
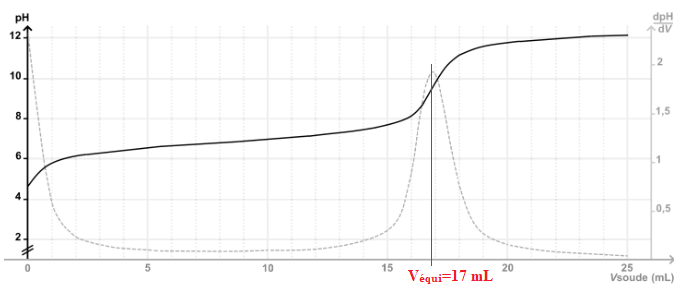
A l'équivalence V
A C
A = V
équi C
B.
C
A =
Véqui CB / VA=17 * 0,100 / 10 =0,17 mol / L.
u(CA) =CA [(u(CB) / CB)2+(u(VA) / VA)2+(u(Véqui) / Véqui)2]½ .
u(CA)=0,17 [(0,002 / 0,100)2+(0,02 / 10)2+(0,5 / 17)2]½ =0,17 [ 4 10-4+4 10-6 +8,6 10-4]½ =6 10-3 mol / L.
CA =0,17 ±6 10-3 mol / L.
Tenir compte de la dilution : 1,7 ±6 10-2 mol / L.
M(acide nonanoïque) = 158,4 g/mol.
(1,7 ±6 10-2) x158,4 =269 ± 10 g / L.
(269 -250) / 10 =1,9 < 2.
La concentration en masse mesurée et la valeur de référence sont donc compatibles.