Fabrication d'un yaourt.
1. Etude cinétique de la fermentation lactique.
La transformation du glucose en acide lactique est modélisée par :
C
6H
12O
6aq --> 2
C3H6O3aq.
On contrôle la concentration CA en quantité de matière d'acide lactique formé dans le yaourt. Les ferments sont introduits à t = 0 s.
Q1. Justifier que l'utilisation de la yaourtière favorise la fermentation lactique.
La température est un facteur cinétique. La yaourtière permet un chauffage doux et progressif du lait additionné des ferments.
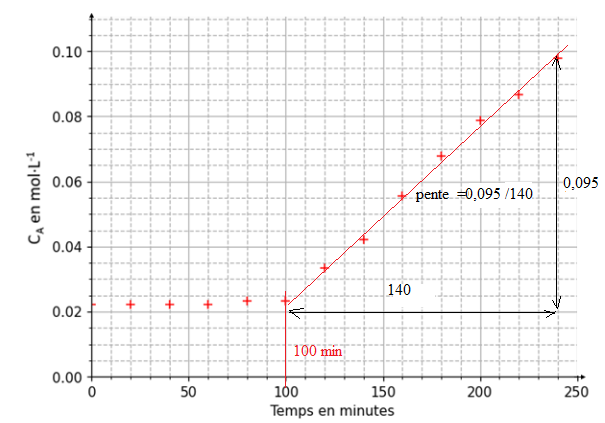
Q2. Identifier le temps marquant le début de la fermentation.
Lorsque la fermentation débute, la concentration en quantité de matière d'acide lactique augmente.
 Q3.
Q3. Proposer une explication à la présence d'acide lactique à t=0.
L'acide lactique est apporté par le sachet de ferments ajoutés initialement.
Q4. Calculer la valeur de la vitesse volumique d'apparition de l'acide lactique lorsque la fermentation a commencé.
vapp = dCa / dt, pente de la droite.
0,095 /140 ~ 6,8,0 10-4 mol L-1 min-1ou 6,8 10-4 / 60 =1,1 10-5 mol L-1 s-1.
Caractérisation du yaourt maison.
Pour
caractériser la fermeté d'un yaourt on prpcède au titrage
conductimétrique de l'acide lactique noté HA aq contenu dans un volume V
A = 10,0 mL de yaourt par une solution d'hydroxyde de sodium de concentration C
b = 0,150 mol / L.
HA aq + HO
-aq --> A
-aq + H
2O(l).
Q5 - Déterminer si le yaourt est ferme ou brassé.
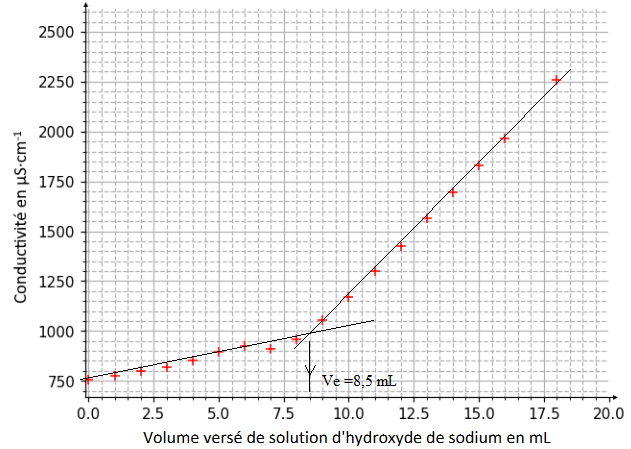
A l'équivalence : V
A C
A = Ve C
b ; C
A =8,5 x0,150 / 10,0 =0,128 mol / L.
M(AH) =90,1 g /mol.
90,1 x 0,128 =11,5 g / L.
Un degré Dornique correspond à0,1 g d'acide lactique par litre de yaourt.
11,5 g / L correspond à 115 °D, valeur comprise entre 100 et 120 °D..
Le yaourt est donc brassé.