Un
emballage intelligent au rayon poissonnerie. Bac métropole 2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| ... |
.
.
|
|
.
.
|
..
..
......
...
|
Un
emballage « intelligent » est un emballage alimentaire capable
d’afficher, à destination du client, des informations qui s’actualisent
automatiquement au cours du temps. On trouve par exemple, sur certains
emballages de produits
frais au rayon poissonnerie, une pastille qui informe de la fraicheur
du filet de poisson qu’ils contiennent. Ces pastilles sont imbibées
d’un indicateur coloré.
Dans cet exercice, on souhaite vérifier si le bleu de bromophénol, un
indicateur coloré acide-base noté BBP dans la suite de l’exercice, peut
convenir pour la réalisation de ce type de pastille.
1. Synthèse du bleu de bromophénol.
Pour synthétiser et caractériser le BBP (C19H10Br4O5S), on réalise le protocole suivant :
- étape n°1 : dissoudre dans un erlenmeyer une masse m = 201 mg de rouge de phénol (C19H14O5S)
dans 10 mL d’éthanol. Agiter, puis ajouter goutte à goutte une solution
contenant du perbromure de pyridinium, qui permet de libérer du dibrome
Br2 dans le milieu ;
- étape n°2 : éliminer le solvant jusqu’à obtenir des cristaux au fond
du ballon. Filtrer puis sécher les cristaux à l’étuve. Le produit
solide obtenu est appelé par la suite le produit synthétisé brut ;
- étape n°3 : réaliser une chromatographie sur couche mince des réactifs et du produit synthétisé brut ;
- étape n°4 : enregistrer les spectres d’absorption du BBP de référence et du produit synthétisé brut.
Données :
- équation de la réaction modélisant la synthèse du BBP :
C19H14O5S(solv) + 4 Br2(solv) → C19H10Br4O5S(solv) + 4 HBr(solv)
où (solv) signifie dissous dans le solvant, ici l’éthanol ;
- concentration standard : c° = 1 mol·L–1 ;
- température de fusion du BBP : 273 °C ;
- pour discuter de l’accord du résultat d’une mesure avec une valeur de référence, on peut utiliser le quotient |x-xref| / u(x)
avec x la valeur mesurée, xref la valeur de référence et u(x) l’incertitude-type associée à la valeur mesurée x ;
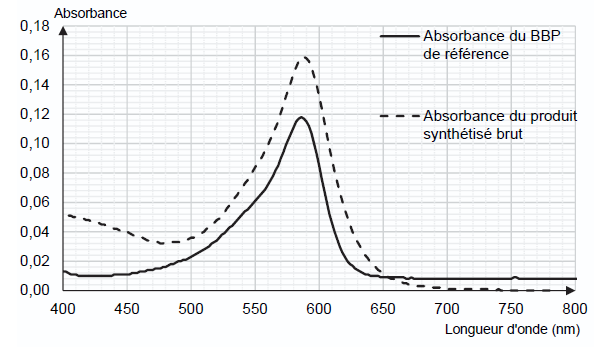
- chromatogramme obtenu du produit synthétisé brut (les espèces étant dissoutes dans un solvant adapté) :

spectres d’absorption du BBP de référence et du produit synthétisé brut :
Q1. Donner un titre aux étapes du protocole, en choisissant parmi les propositions suivantes : analyse du
produit brut ; transformation des réactifs ; séparation.
Etape1 : transformation des réactifs.
Etape 2 : séparation.
Etapes 3 et 4 : analyse du produit brut.
Q2. En vous appuyant sur le chromatogramme obtenu, montrer qu’une transformation chimique a eu lieu et
préciser si le produit synthétisé brut est pur.
Le produit brut ne présente pas de tache à la même hauteur que le rouge de phénol : ce dernier a été consommé.
Une nouvelle tache apparaît pour le produit brut : formation d'une nouvelle espèce.
Une transformation chimique a eu lieu.
Le produit issu de la synthèse présente deux taches : ce produit n'est pas pur ( présence de perbromure de pyridium).
Q3. À l’aide des spectres d’absorption proposés, justifier que le produit brut contient du BBP.
Les deux spectres possèdent un maximum d'absorption pour la même longueur d'onde : le produit brut contient du BBP.
Q4. Citer une autre méthode permettant d’identifier le produit brut.
Le produit étant solide, on peut mesurer la température de fusion à l'aide d'un banc Koffler. On doit trouver 273°C.
On peut aussi utiliser la spectroscopie IR.
2. Identification du produit synthétisé par une mesure de pKa
Le produit brut obtenu est purifié. On se propose d’en déterminer la constante d’acidité associée pour
confirmer qu’il s’agit de BBP, en étudiant la courbe de titrage d’une solution contenant cette espèce par une
solution aqueuse d’hydroxyde de sodium.
Q5. Le BBP est un indicateur coloré acide-base dont le couple acide-base est noté BH2(aq) / BH–(aq). Donner
l’expression de la constante d’acidité Ka de ce couple en fonction de [BH2], [BH–], [H3O+], concentrations des
espèces à l’équilibre chimique, ainsi que de la concentration standard c°.
Ka = [BH–]éq [H3O+]éq / ([BH2]éq c°)
Q6. À partir de l’expression précédente, établir la relation suivante :
log Ka = log([BH–]éq /[BH–]éq) +log([H3O+]éq)
pKa = -log (Ka)=- log([BH–]éq /[BH–]éq) -log([H3O+]éq)
pKa = -log (Ka)=- log([BH–]éq /[BH–]éq)+pH.
pH = pKa+ log ([BH–] / [BH2]
On prépare une solution Sa du produit de synthèse purifié. On réalise un titrage de la solution Sa à l’aide d’une solution Sb d’hydroxyde de sodium, suivi par pH-métrie.
L’équation de la réaction support du titrage est :
BH2(aq) + OH–(aq) → BH–(aq) + H2O(ℓ)
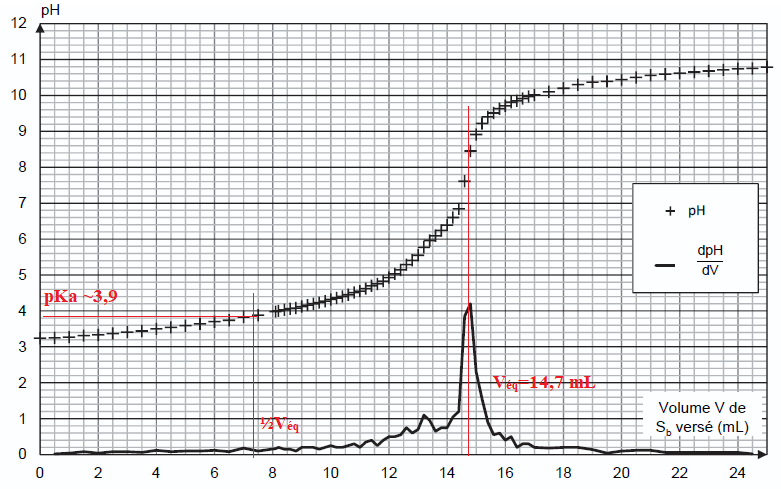
La courbe de titrage est donnée sur la figure 1 ci-dessous.
Q7. Définir l’équivalence d’un titrage.
A l'équivalence, les réactifs sont en proportions stoéchiométriques.
Q8. En explicitant la méthode, déterminer le volume Véq de solution Sb versé à l’équivalence.
Saut de pH à l'équivalence ; dpH / dv présente un maximum ; Véq = 14,7 mL.
Pour déterminer expérimentalement le pKa du couple BH2(aq) /BH–(aq), on s’intéresse à un point particulier de la courbe, la demi-équivalence, atteint pour un volume versé égal à ½Véq.
Q9. Montrer que [BH–]= [BH2] à la demi-équivalence.
A la demi-équivalence pH = pKa :
par suite log ([BH–] / [BH2]) =0 soit [BH–] / [BH2] = 1.
Q10. En déduire, en explicitant la démarche utilisée, la valeur expérimentale du pKa du couple BH2(aq) / BH–(aq).
pKa = 3,9 d'après le graphe.
Q11. Sachant
que la valeur tabulée du pKa à 25 °C de ce couple est égale à 4,1,
indiquer si la valeur obtenue à la question Q10 est compatible avec la
présence de BBP dans le produit de synthèse purifié. L’incertitude type
sur la mesure du pKa est évaluée à u(pKa) = 0,3.
|pKa -pKa référence| / u(pKa) = |3,9-4,1| / 0,3 =0,7 < 2.
La valeur est compatible.
|
...
|
....
|
3. Étude de la couleur de la pastille dans l’emballage intelligent
Une pastille est imprégnée par une solution de BBP. Cet indicateur
coloré a des formes acide et basique de couleurs différentes en
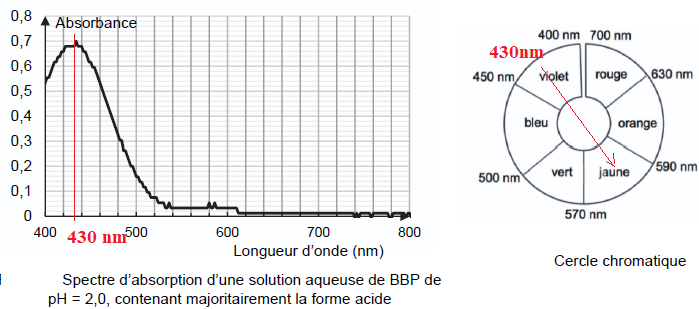
solution. On donne ci-dessous le spectre d’absorption d’une solution
aqueuse contenant majoritairement la forme acide.
Une solution contenant majoritairement la forme basique du BBP est de couleur bleue ;
- masse volumique de l’eau à 20 °C : ρeau = 1,0 kg·L–1 ;
- masse molaire du chlorure d’hydrogène : M = 36,5 g·mol–1 ;
Q12. Montrer que la solution contenant la forme acide du BBP est de couleur jaune.
le maximum d'absorption se situe vers 430 nm ( violet).
La solution possède la couleur complémentaire du violet, soit le jaune.
Pour obtenir le spectre , il est nécessaire de préparer une solution
d’acide chlorhydrique de pH = 2,0. La solution commerciale utilisée au
laboratoire est de titre massique tm = 37 % et de densité d = 1,18.
On dispose de pipettes jaugées de volumes usuels entre 1,0 mL et 50,0 mL et d’une fiole jaugée de volume V = 200,0 mL.
Q13. Montrer qu’il est impossible de préparer cette solution en ne réalisant qu’une seule dilution avec le matériel proposé.
Masse de 1 L : 1,18 kg.
Masse d'acide pur dans 1 L: 1,18 x 0,37 ~0,44kg ou 440g.
Quantité de matière : 440 / M(HCl) = 440 / 36,5 ~12 mol / L.
Concentration de la solution d'acide chlorhydrique de pH = 2 : C = 0,010 mol / L.
Facteur de dilution : 12 /0,010 = 1200.
Volume de solution mère à prélever : 200,0 / 1200 =0,17 mL.
Il est impossible de préparer cette solution en ne réalisant qu’une seule dilution avec le matériel proposé.
Au cours du temps, les bactéries contenues dans le poisson produisent
naturellement des molécules de N,N-diméthylméthanamine qui entrent en
contact avec la pastille imbibée de BBP.
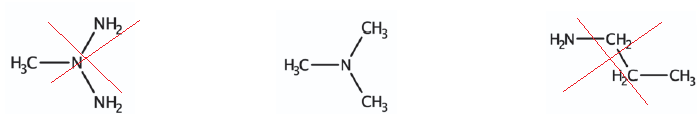
Q14. Choisir, parmi les trois formules semi-développées suivantes, celle qui correspond à la molécule de N,N-diméthylméthanamine.
Au cours de la dégradation du poisson, qui se réalise sur plusieurs
jours, la N,N-diméthylméthanamine, composé volatil, est produite. La
pastille de BBP initialement jaune se colore alors en bleu.
Q15. Écrire l’équation de la réaction modélisant la transformation chimique responsable de ce changement de
couleur. On note BH2(aq) / BH–(aq) le couple acide-base correspondant au BBP, et R3NH+(aq) / R3N(aq) celui associé à la N,N-diméthylméthanamine.
R3N(aq)+BH2(aq) -->BH–(aq)+R3NH+(aq).
4. Cinétique d’ordre 1 de la décoloration du BBP en présence d’ion hydroxyde
L’ion BH– est une espèce amphotère. Les molécules de
N,N-diméthylméthanamine produites lors de la dégradation du poisson
rendent le milieu basique. En milieu très basique, le BBP se décolore
selon une transformation chimique lente, considérée totale et modélisée
par la réaction d’équation suivante :
BH–(aq) + OH–(aq) → B2–(aq) + H2O(ℓ)
Q16. Justifier le caractère amphotère de l’ion BH–.
BH–(aq)appartient aux couples acide /base :
acide du couple BH-aq / B2-aq et base du couple BH2aq / BH-aq.
BH-aq est amphotère.
On souhaite savoir si cette transformation peut nuire à l’efficacité d’un emballage intelligent.
Pour cela, on suit l’évolution de la concentration en ions BH- , en fonction du temps, dans une solution très basique. Le protocole mis en place est le suivant :
- placer un volume d’une solution contenant des ions BH- dans une fiole jaugée de 50,0 mL ;
- compléter jusqu’au trait de jauge avec une solution aqueuse d’hydroxyde de sodium introduite en excès ;
- suivre l’évolution de l’absorbance par spectrophotométrie pendant une
trentaine de minutes et tracer l’évolution temporelle de la
concentration en ions BH–, notée [BH–] (voir figure).
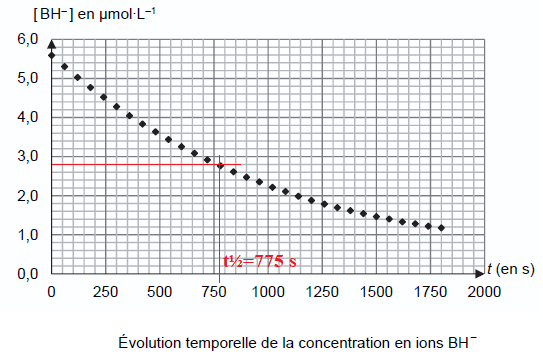
Q17. Après avoir
déterminé le temps de demi-réaction, indiquer si ce temps
caractéristique et la réaction associée sont adaptés à une utilisation
dans la pastille d’un emballage intelligent. Détailler votre
raisonnement en explicitant les évolutions de la couleur de la pastille
de l’emballage au cours du temps.
775 s ~ 13 min.
La disparition du bleu est rapide. L'étiquette passera du jaune à l'incolore.
Ce changement de couleur n'est pas très visible pour un consommateur. Ce n'est pas adapté pour un emballage intelligent.
|
|
|
|