L'eau
de Quinton. Bac métropole 2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| ... |
.
.
|
|
.
.
|
..
..
......
...
|
L’objectif de cet exercice est de déterminer la teneur en ions chlorure d’une eau de Quinton commerciale
provenant d’une mer bretonne, à l’aide d’un titrage suivi par conductimétrie.
- concentration moyenne en masse en ions chlorure d’une eau de mer bretonne : 19,4 g·L–1 ;
- la concentration en ions chlorure dans le sang est comprise entre 100 et 110 mmol∙L–1 ;
Dans le contexte de cet exercice, on peut qualifier une eau de Quinton d’isotonique si sa concentration en ions
chlorure est dans l’intervalle des valeurs de celles du sang, d’hypertonique si elle est supérieure à
110 mmol∙L–1 et d’hypotonique si elle est inférieure à 100 mmol∙L–1.
1. Préparation de l’eau de Quinton isotonique
Une eau de Quinton isotonique est préparée en diluant 5 fois l’eau de Quinton commerciale hypertonique étudiée.
Q1. Proposer un protocole permettant de préparer 100,0 mL d’eau de Quinton isotonique à partir d’eau de
Quinton commerciale. Nommer, en précisant les volumes, la verrerie utilisée.
Facteur de dilution : 5. Fiole jaugée de 100 mL conternant un tiers d'eau distilée.
Prélever 100 / 5 = 20,0 mL d'eau de Quinton commerciale à l'aide d'une pipette jaugée de 20,0 mL et verser dans la fiole jaugée.
Compléter jusqu'au trait de jauge avec de l'eau distillée.
Boucher et agiter pour rendre homogène.
Q2. Vérifier le caractère isotonique de la solution ainsi préparée.
19,4 / M(Cl) = 19,4 / 35,5 =0,546 mol / L.
0,546 / 5 =0,109 mol / L = 109 mmol / L
Cette valeur appartenant à l'intervalle {100 ; 110], la solution est isotonique.
2. Analyse d’une eau de Quinton hypertonique
On assimile l’eau de Quinton hypertonique étudiée à une solution aqueuse de chlorure de sodium(Na+(aq) ; Cℓ–(aq)).
Afin d’en déterminer la concentration en ions chlorure, on réalise un titrage suivi par conductimétrie.
À l’aide d’une pipette jaugée, on prélève un volume V1 = 10,0 mL d’eau de Quinton hypertonique que l’on
introduit dans un bécher, dans lequel on ajoute 200 mL d’eau distillée.
On dose la solution obtenue par une solution titrante de nitrate d’argent (Ag+(aq) ; NO3 – (aq) de concentration
C2 = 3,00×10–1 mol·L–1. Les ions argent forment avec les ions chlorure un précipité de chlorure d’argent
AgCℓ(s). Cette réaction de précipitation peut être considérée comme totale.
Q3. Écrire l’équation de la réaction modélisant la transformation mise en jeu au cours du titrage.
Ag+(aq) +Cl-(aq) --> AgCl(s).
On utilise le langage de programmation Python pour simuler et représenter l’évolution des concentrations des
espèces qui participent à la conductivité de la solution titrée en fonction du volume de solution titrante
versé. On néglige la dilution liée à l’ajout de la solution titrante.
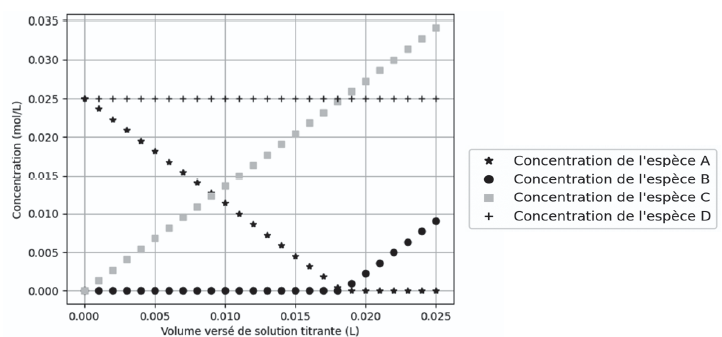
Q4. Identifier, en justifiant, les espèces A, B, C et D.
La concentration de l'espèce A diminue puis s'annule : Cl-.
La concentration de l'espèce B est nulle jusqu'à l'équivalence puis augmente : Ag+.
La concentration de l'espèce c est initialement nulle puis augmente : NO3-.
La concentration de l'espèce D est constante : Na+.
Q5. Donner l’expression de la ligne 15 du programme Python permettant de calculer la valeur du volume à
l’équivalence, noté V_E, en fonction de C_A, C_B et V_A.

On a reporté l’évolution de la conductivité s en fonction du volume V2 de solution de nitrate d’argent versé.
Q6. En utilisant les résultats de la simulation, expliquer l’évolution de la conductivité mesurée au cours du dosage.
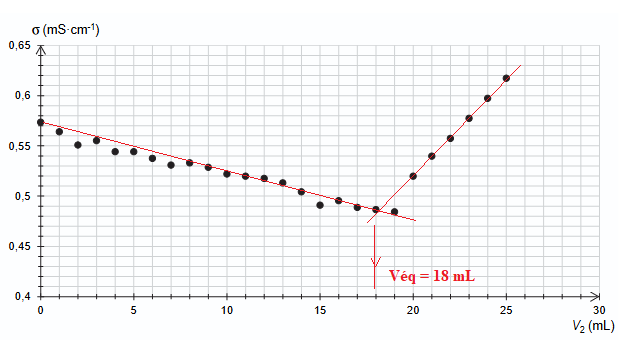
Avant l'équivalence l'ion argent est en défaut : du point de vue de la
conductivité tout se passe comme si on remplaçait les ions
chlorure par des ions nitrate de conductivité molaire ionique
moindre. La conductivité de la solution diminue.
Après l'équivalence, l'ion argent est en excès et on ajoute des ions nitrate. La conductivité de la solution croît.
Q7. Exploiter les résultats expérimentaux pour déterminer la concentration en masse C des ions chlorure
dans l’eau de Quinton.
A l'équivalence : [Ag+] Véq =C V1
C = 0,300 x 18 / 10,0 =0,54 mol / L.
0,54 x35,5 = 19,1 g/ L.
L’incertitude-type u(CQuinton) associée à la valeur de la concentration en masse trouvée précédemment est,
dans cette situation :
u(CQuinton) = CQuinton×[(u(V1) / V1)2 +(u(VE) / VE)2 +(u(C2) / C2)2 ]½.
avec u(VE) = 0,5 mL, u(V1) = 0,02 mL et u(C2) = 2×10–3 mol·L–1.
Q8. Vérifier si la concentration trouvée est en accord avec la concentration en ions chlorure de l’eau de mer
bretonne.
u(CQuinton) = 19,1×[(0,02 / 10)2 +(0,5 / 18)2 +(2×10–3 / 0,300)2]½.
u(CQuinton) = 19,1×[4 10-6 +7,7 10-4 +4,4 10-5]½ =0,55~0,6.
C = 19,1 ±0,6 g / L.
|CQuinton -Créf) / u(Quinton)=(19,4-19,1) / 0,6 =0,5 < 2.
Donc accord entre la valeur expérimentale et la valeur de référence.
|