Un
parfum de rose. Bac métropole 2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| ... |
.
.
|
|
.
.
|
..
..
......
...
|
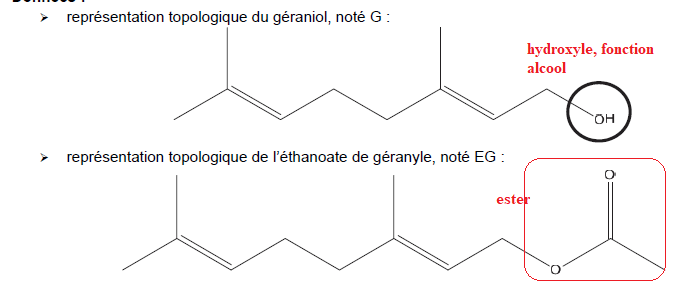
L’objectif de cet exercice est d’étudier quelques propriétés du géraniol et son utilisation dans la synthèse de
l’éthanoate de géranyle.
1. Étude préliminaire
Q1. Nommer le groupe caractéristique entouré sur la représentation topologique du géraniol. Identifier les
familles chimiques auxquelles appartiennent le géraniol et l’éthanoate de géranyle.
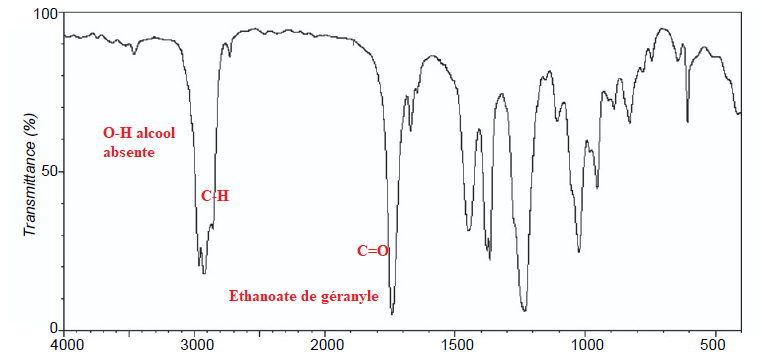
Q2. Attribuer, en justifiant, le spectre infrarouge représenté sur la figure 1 ci-après à la bonne espèce chimique
parmi le géraniol et l’éthanoate de géranyle.
2. Transformation du géraniol en éthanoate de géranyle
L’éthanoate de géranyle peut être synthétisé en faisant réagir du géraniol avec de l’acide éthanoïque
CH3CO2H. Cette transformation chimique, appelée estérification, est lente et non totale. Les étapes du
mécanisme réactionnel de cette estérification sont données ci-dessous. Afin de simplifier les écritures, le
géraniol est dorénavant noté R–OH et l’éthanoate de géranyle est dorénavant noté CH3COO–R dans toute la
suite de l’exercice.
Q3. Rappeler la définition d’un catalyseur puis identifier, en justifiant, l’espèce chimique qui catalyse la réaction
d’estérification.
Un catalyseur accélère une réaction thermodynamiquement possible. Il est régénéré lors de la dernière étape.
Ion H+.
Q4.
Représenter les flèches courbes expliquant la formation et/ou la
rupture des liaisons mises en jeu lors des étapes 1, 2 et 5.
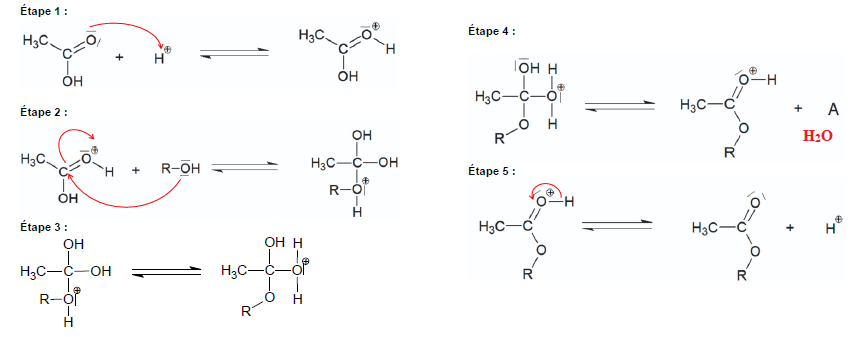
Q5. Donner la formule brute de l’espèce chimique notée A dans l’étape 4 puis écrire l’équation de la réaction
d’estérification entre le géraniol et l’acide éthanoïque.
R-OH + CH3COOH --> CH3COO–R +H2O.
|
...
|
....
|
La synthèse de l’éthanoate de géranyle est réalisée en laboratoire avec le protocole expérimental suivant :
- dans un erlenmeyer, surmonté d’un réfrigérant à air, introduire un volume VA = 50 mL d’une solution aqueuse d’acide éthanoïque à la concentration CA = 1,0 mol·L–1 ainsi qu’une masse m = 7,7 g de géraniol pur ;
-
ajouter deux gouttes d’acide sulfurique concentré (quantité négligeable
devant la quantité d’acide éthanoïque introduit dans l’étape
précédente) ;
- chauffer à 55 °C au bain-marie pendant deux heures ;
- verser le mélange refroidi dans une ampoule à décanter et séparer la
phase aqueuse, qui contient l’acide éthanoïque restant, de la phase
organique, qui contient l’éthanoate de géranyle synthétisé et le
géraniol restant.
Q6. Indiquer l’intérêt de chauffer le mélange.
La température est un facteur cinétique : la vitesse de la réaction augmente en chauffant.
Q7. Indiquer, en justifiant, la position relative et le contenu des phases dans l’ampoule à décanter.
La phase aqueuse la plus dense occupe la partie inférieure de
l'ampoule. La phase organique moins dense occupe la partie supérieure.
Q8. Vérifier par le calcul que l’acide éthanoïque et le géraniol sont introduits dans les proportions stoechiométriques.
Acide éthanoïque : CAVA = 50 mmol.
Géraniol : mG / m(géraniol) = 7,7 / 154,25 =0,050 mol / 50 mmol.
Pour
déterminer la quantité d’éthanoate de géranyle formée, on dose l’acide
éthanoïque restant dans la phase aqueuse à l’aide d’une solution
aqueuse d’hydroxyde de sodium à la concentration CB = 1,0 mol·L–1. Le titrage est suivi par pH-métrie et la courbe obtenue est représentée.
Q9. Écrire
l’équation de la réaction support du titrage puis, à l’aide de la
courbe de titrage, déterminer, en explicitant la démarche, la quantité
de matière d’acide éthanoïque restant dans le milieu réactionnel après
deux heures de chauffage.
CH3COOHaq+HO- aq --> CH3-COO-aq +H2O(l).
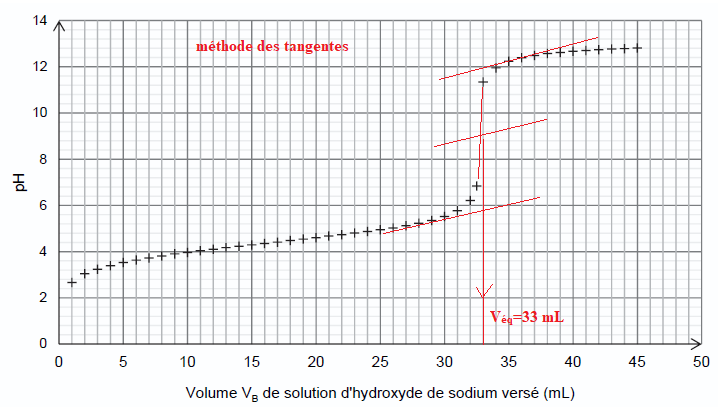
A l'équivalence : CB Véq =1,0 x33 = 33 mmol.
Q10. Déterminer le rendement de la réaction d’estérification.
Quantité expérimental d'ester / quantité théorique = (50-33) /50 = 0,34 ( 34%).
3. Utilisation du géraniol en parfumerie
Le géraniol fait partie des substances allergènes que l’on retrouve
dans les parfums. Une personne peut être exposée sans risque à une dose
de géraniol inférieure à 17,75 mg par kg de masse corporelle.
Les informations suivantes sont recueillies sur l’étiquette d’un parfum vendu dans le commerce :
- le parfum contient 0,001 % en masse de géraniol ;
- une pulvérisation contient 0,15 mL de parfum ;
- la densité du parfum est d = 0,84.
Q11. Déterminer le
nombre maximal de pulvérisations d’un parfum qu’une personne, de masse
65 kg, peut effectuer sans se mettre en danger. Commenter.
Dose maximale : 17,75 x65 =1154 mg=1,15 g.
Masse de parfum dans une pulvérisation :
0,15 x0,84 =0,126 g.
Masse de géraniol dans une pulvérisation : 0,126 x0,001 / 100 =1,26 10-6 g.
Nombre maximal de pulvérisations : 1,15 / (1,26 10-6) =9 105.
Valeur très élevée difficile à atteindre.
|
|
|
|