Etude
d'un produit ménager " fait maison".
Bac Polynésie 2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| ... |
.
.
|
|
.
.
|
..
..
......
...
|
Objectif : étude de la transformation chimique entre le vinaigre blanc à 8 % et le bicarbonate de soude.
Q1. Représenter la formule semi-développée de l'acide éthanoïque.
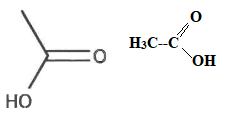
Q2. Montrer
que la quantité de matière en acide éthanoïque n contenue dans V = 1,0
L de vinaigre blanc à 8,0 % en masse est voisine de 1,3 mol.
r = 1,01 g / mL.
Masse d'acide éthanoïque dans 1 L : 1,01 103 * 0,08 =80,8 g.
M(ac. éthanoïque) = 60 g/ mol.
80,8 / 60 =1,3 mol.
Q3.
Ecrire l'équation de la réaction entre l'aciide éthanoïque noté AH et l'eau.
AH aq + H2O(l) = A-aq +H3O+aq.
Q4. Exprimer la constante Ka du couple AH / A-.
Ka = [A-aq] [H3O+aq] / ([AH aq] c°).
Q5 Q6. Déterminer Ka. Attribuer à chaque courbe l'espèce correspondante.
A pH < pKa la forme AH prédomine. A pH > pKa la forme A- prédomine.
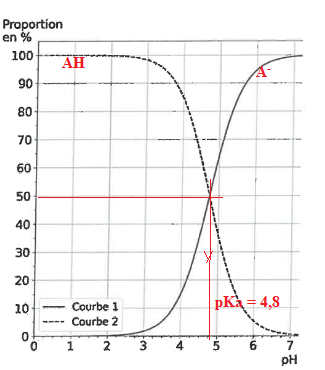
Ka = 10-4,8 = 1,6 10-5.
Q7.Q8 Ecrire l'équation modélisant la réaction entre l'acide éthanoïque et l'ion hydrogénocarbonate.
AH aq + HCO3-aq -->A-aq + CO2 aq + H2O(l)
Le dégagement de dioxyde de carbone conduit à la formation de mousse lors de cette réaction.
Dans un erlenmeyer on introduit : Vvinaigre = 100 mL de vinaigre à 8,0 % en masse
n' = 0,20 mol d'ion hydrogénocarbonate.
On recueille le gaz dans un tube par déplacement d'eau. La valeur de la
pression du gaz dans le tube est P = 1020 hPa et la température est
égale à 25°C.
Q9. Calculer le volume V du gaz libéré.
Etat
|
avancement (mol)
|
AH aq
|
+HCO3-aq
|
= CO2(g)
|
+ H2O(l) |
Initial
|
0
|
0,13
|
0,20
|
0
|
solvant
|
final
|
xf
|
0
|
0,20-xf
|
xf = 0,13
|
P V = n RT.
n = 0,130 mol ; T = 273+25 = 298 K. P = 1,02 105 Pa.
V = 0,13 x 8,314 x 298 / (1,02 105) =3,1 10-3 m3 = 3,1 10-6 L.
|