Exercice 1 : La fumée de cigarette.
La fumée de cigarette contient de nombreux produits hautement
cancérigènes, dangereux
pour le fumeur mais aussi pour son entourage.
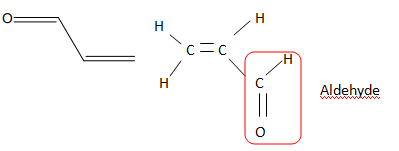
L'acroléine, molécule présente dans la fumée de cigarette est un
irritant majeur. Sa formule topologique est donnée.
1. Écrire la
formule développée de la molécule
2. Sur cette formule,
entourer un groupe fonctionnel présent dans
la molécule et donner son nom.
Parmi les constituants toxiques de la cigarette, on trouve
également le polonium 210 qui est
un élément radioactif. Son équation de désintégration s’écrit :
21084Po →
20682Pb* +
42He
3. Indiquer la nature de
la désintégration radioactive mise en jeu.
Emission d'un noyau d'hélium : radioactivité de type alpha.
4. Le noyau
20682Pb*
est instable, il se transforme en un noyau stable
20682Pb
. Préciser le type de
radioactivité mis en jeu.
Emission
g.
Le toluène est aussi une espèce chimique présente dans le tabac.
Si sa combustion est
incomplète, alors elle conduit à la formation d’eau H
2O et
de monoxyde de carbone CO, gaz
dangereux, potentiellement mortel.
5. Recopier et
ajuster l’équation de la réaction modélisant la combustion incomplète
du
toluène :
2 C
7H
8 +
11 O
2
→
14CO +
8H
2O.
Une patiente bénéficiant d'oxygénothérapie dispose d’une bouteille de
dioxygène portable de
2,0 litres (L), à la pression P = 100 bars, à la température de 20 °C.
6. Montrer que la
quantité de matière de dioxygène contenue dans la bouteille comprimée
est
voisine de 8,2 mol.
Equation des gaz parfaits : PV = n RT.
n = PV / (RT) = 100 10
5 * 2 10
-3 /(8,31
x(273+20))=8,2 mol.
7. En déduire que
le volume de dioxygène utilisable à la sortie de la bouteille à la
pression de
1,013 × 10
5 Pa est de l’ordre de 200 L à la température de
20°C.
V = n RT / P = 8,2 *8,31 *(273+20) / (1,013 10
5) =0,2 m
3
= 200 L.
8. La patiente doit
maintenir en permanence un débit de dioxygène de 1,5 L·min
-1
à la
pression de 1,013 × 10
5 Pa. Calculer la durée d’utilisation
de la bouteille.
200 / 1,5 =133 min.
Exercice 2 : Le tabagisme
passif.
Le tabagisme passif est défini comme l'inhalation involontaire de
la fumée de tabac.
Document 1
: Les ions thiocyanate, marqueurs du tabagisme.
L’acide cyanhydrique HCN est l’une des substances chimiques
présente dans la fumée du
tabac. L’exposition fréquente à cette substance est toxique. En se
dégradant, elle produit
des ions thiocyanate SCN
- qui sont des marqueurs biologiques
du tabagisme.
Le dosage par étalonnage des ions thiocyanate dans la salive permet de
mesurer
l’exposition d’une personne à la fumée de cigarette.
La concentration habituelle en ions thiocyanate dans la salive pour un
non-fumeur varie
entre 50 et 200 mg·L
-1
. Chez les fumeurs, on peut rencontrer des concentrations voisines
de 400 mg·L
-1
.
L’acide cyanhydrique peut réagir avec l’eau selon une réaction
acido-basique.
1. Écrire
l’équation de réaction de l’acide cyanhydrique avec l’eau.
Les couples mis en jeu sont : HCN(aq) / CN
-
(aq) et H
3O
+
(aq) / H
2O(l).
HCN(aq) +H2O(l) --> H3O+
(aq) +CN-
(aq)
2. Justifier que
HCN est un acide selon Brönsted.
HCN aq est susceptible de libéré
H3O+
(aq). C'est donc un acide au sens de Brönsted.
Document 2
: Principe du dosage par étalonnage des ions thiocyanate.
L’ion thiocyanate étant incolore, on le fait réagir avec des ions
fer III pour former un ion
coloré dont la concentration en quantité de matière est égale à la
concentration initiale des
ions thiocyanate SCN
-
(aq).
Le dosage par étalonnage consiste à mesurer l’absorbance A, à une
longueur d’onde
correctement choisie, d’une gamme de solutions étalons de
concentrations différentes afin
d’obtenir une courbe d’étalonnage.
Une solution mère S
0 d’ions thiocyanate SCN
-
(aq) est préparée. Les solutions étalons sont
obtenues par dilution de la solution mère avec une solution contenant
des ions Fe
3+(aq) .
La concentration en ions thiocyanate dans l’échantillon de salive,
préparé dans les mêmes
conditions que les solutions étalons, est déterminée par lecture
graphique à partir de la
mesure de son absorbance.
On souhaite réaliser le dosage des ions thiocyanate dans la salive d’une personne non
fumeuse selon le protocole décrit dans le document 2.
Pour cela, on prépare une solution mère de thiocyanate S
0 à la concentration en quantité de
matière C = 3,44 × 10
-4 mol·L
-1
.
On prépare 1,0 L de cette solution à partir du thiocyanate de potassium solide correspondant,
KSCN(s), qu’on dissout dans de l’eau. Le solide libère ainsi des ions thiocyanate SCN
-
(aq) et
potassium K
+
(aq) lors de sa mise en solution.
Données :
M(KSCN) = 97,2 g·mol
-1
; M(SCN
-
) = 58,1 g·mol
-1
.
3. Écrire l’équation de la réaction modélisant la dissolution du thiocyanate de potassium dans
l’eau.
KSCN(s) -->K
+aq + SCN
-aq.
4. Montrer que la masse de thiocyanate de potassium solide à peser pour réaliser cette
solution S
0 est voisine de 33 mg.
3,44 10
-4 x97,2 =3,33 10
-2 g ou 33 mg.
5. Décrire le mode opératoire pour préparer la solution S
0.
Peser 33 mg de solide à l'aide d'une balance de précision.
Verser dans une fiole jaugée de 1,0 L contenant 1 /3 d'eau distillée.
Agiter jusqu'à dissolution.
Compléter jusqu'au trait de jauge avec de l'eau distillée.
Agiter pour rendre homogène.