Mathématiques,
physique chimie. Bac STL 2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| ... |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice 1. 5 points.
On peut synthétiser l’arôme d'abricot en laboratoire
pour l’utiliser dans des produits de beauté et des aliments. La molécule correspondant à
l'arôme d'abricot est le propanoate d'isoamyle. Pour le synthétiser, on fait réagir du
3-méthylbutan-1-ol et de l'acide propanoïque en présence d’acide sulfurique, utilisé
comme catalyseur.
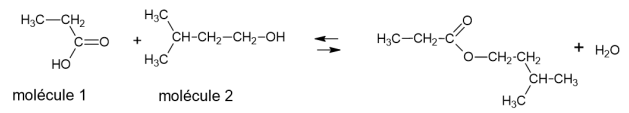
1. Écrire les formules topologiques des molécules 1 et 2.
2. Entourer le groupe caractéristique présent dans la molécule 2 sur la formule
topologique précédente et nommer la fonction chimique associée à ce groupe.
3. Préciser le rôle du catalyseur.
Un catalyseur augmente la vitesse de la réaction chimique.
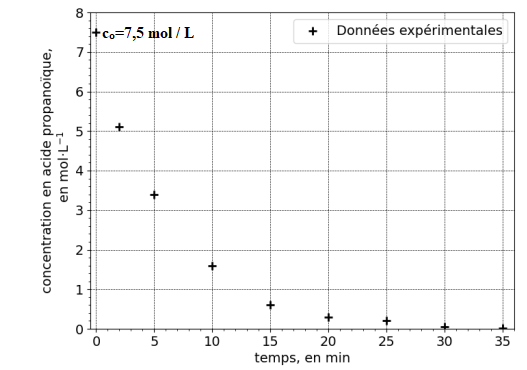
La figure 1 ci-dessous présente l’évolution, en fonction du temps t, de la valeur de la
concentration en acide propanoïque lors de la réaction de synthèse du propanoate
d’isoamyle.
4. Déterminer, par lecture graphique, la concentration initiale Co en acide
propanoïque.
La figure ci-dessous présente l’évolution du logarithme népérien de la concentration
en acide propanoïque en fonction du temps 𝑡.
La droite d’équation 𝑦 = −0,154𝑡 + 2,01 est une approximation affine des points obtenus.
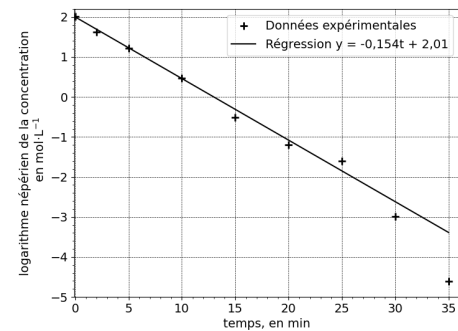
5. Préciser l’ordre de cette réaction.
Réaction d'ordre 1.
6. Par identification, donner la valeur de la constante de vitesse k.
Valeur absolue du coefficient directeur de la droite k = 0,154 min-1.
On définit la fonction C modélisant la concentration en acide propanoïque en fonction du
temps t. On admet que, pour tout réel t positif, ln(C(t)) = −0,154t + 2,01.
7. [Mathématiques] Vérifier que C(t)) = e
2,01 × e
−0,154 t
.
C(t) = exp( −0,154t + 2,01) = e
2,01 × e
−0,154 t
.
Pour la suite de l’exercice, on admettra que pour tout réel t positif, C(t) = 7,5 × e
−0,154t
.
8. Donner la définition du temps de demi-réaction 𝑡1/2.
9. Déterminer, par le calcul, la valeur de t½.
A t½ la concentration en acide propanoïque est égale à la moitié de la concentration initiale.
10. [Mathématiques] Déterminer la limite de C(t) lorsquet tend vers +oo.
e
−0,154t tend vers zéro et C(t) tend vers zéro.
11. Interpréter votre résultat à partir de la figure.
L'acide propanoïque est entiérement consommé au bout d'un temps suffisamment long. C'est le réactif limittant.
Exercice 2. 6 points.
Pour quelques dizaines d’euros, il est possible de se procurer, sur des sites de commerce
en ligne, des pointeurs laser dits « récréatifs ». Au sujet de l’un d’entre eux, on peut ainsi
lire : « un laser idéal en usage astronomique pour pointer les ciels étoilés et des objets à
très longue distance ou étonner vos amis ». Ses caractéristiques sont :
Puissance 100 mW ; longueur d'onde émise 532 nm ; divergence du faisceau 5 10-4 rad ; classe 3B ; temps d'utilisation en continu : 30 s.
1. Conclure,
sans calcul, quant à la dangerosité de l’utilisation du laser présenté.
Laser dont la vision directe est dangereuse pour un oeil non protégé..
On s’intéresse au cas d’un avion de ligne à l’atterrissage et dont la cabine de pilotage
est éclairée par ce faisceau laser, pointé depuis le sol et situé à une distance égale à
un kilomètre de la cabine. En supposant que ce faisceau a une section circulaire, on
peut montrer que son diamètre est de 0,5 m au terme d’une propagation rectiligne sur
un kilomètre.
2. Citer la propriété des lasers expliquant la faible valeur du rayon de ce faisceau au
terme d’une propagation sur une distance égale à un kilomètre.
Le faisceau laser est très directif ; sa divergence est très faible 5 10-4 rad.
On rappelle que l’éclairement énergétique E reçu par une surface est le flux énergétique par
unité de surface qu’elle reçoit.
3. Montrer que la valeur de l’éclairement énergétique E mesuré au niveau de la
cabine est proche de 500 mW · m−2
.
S = p R2 =3,14 x 0,52/4 =0,196 m2.
100 / 0,196=509 mW m-2.
On admet que, à cette longueur d’onde, un éclairement par un faisceau laser de
quelques µW · cm−2 est responsable d’un fort éblouissement.
4. Exprimer l’éclairement au niveau de l’œil du pilote en µW · cm−2 sachant que
1 mW · m−2 équivaut à 10−1 µW · cm−2
.
509 x0,1 ~ 51 µW cm-2.
5. À l’aide des résultats des calculs précédents, conclure quant à la dangerosité de
ce laser
Ce laser est dangereux en cas de vision directe pour l'oeil non protégé..
Ces pointeurs verts partagent tous le même principe de fonctionnement présenté ci-dessous :
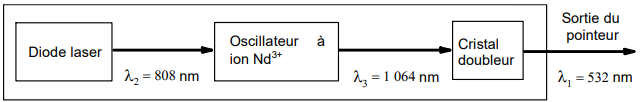
Une diode laser délivre un faisceau laser à une longueur d’onde 808 nm. Ce faisceau
« excite » un oscillateur à ion Néodyme (Nd3+) qui délivre un faisceau laser à 1 064 nm.
La propagation de ce faisceau dans un cristal dit « doubleur de fréquence » se traduit
alors par la génération d’un faisceau laser à 532 nm.
6. Nommer les domaines respectifs des ondes électromagnétiques auxquels
appartiennent des longueurs d’onde de 1 064 nm et de 532 nm.
1064 nm : infrarouge ; 532 nm : visible.
On rappelle que la longueur d’onde l et la fréquence f sont reliées par la relation l =
c / f où c est la célérité de la lumière dans le vide, de valeur 3 × 108 m · s
−1
.
7. Expliquer en quoi le passage d’une longueur d’onde de 1 064 nm à 532 nm conduit
à un doublage de fréquence.
f = c / l ; si la longueur d'onde est divisée par 2, la fréquence f double.
Au laboratoire, on réalise l’analyse spectrale du faisceau de sortie d’un pointeur laser de
conception analogue au laser récréatif mais de puissance moindre. Les résultats
expérimentaux obtenus sont présentés :
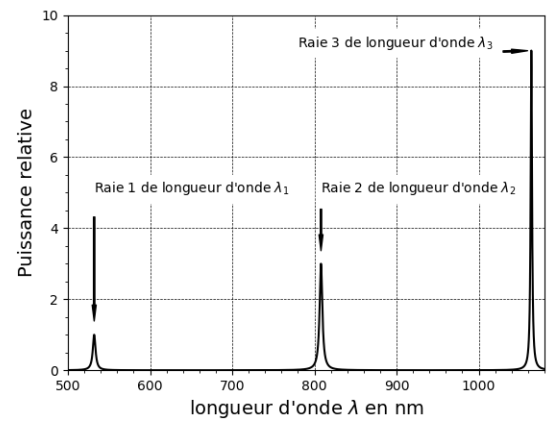
8. Comparer les puissances relatives des rayonnements lasers correspondants aux
trois longueurs d’onde identifiées sur la figure.
Pour les longueurs d'onde l1 et l2 la puissance relative est la même.
La puissance relative de la radiation l3 est deux fois plus grande que la puissance relative associée aux longueurs d'onde l1 et l2 .
9. Justifier, à partir de la figure pourquoi il est nécessaire d’incorporer un dispositif
optique permettant de ne laisser passer que la longueur d’onde de 532 nm à la
suite du cristal doubleur.
La puissance relative de la radiation à 1064 nm est trop dangereuse.
10. Citer la propriété du rayonnement laser ainsi obtenu.
Le rayonnement est monochromatique.
|
...
= =
|
....
|
Exercice 4. 4 points.
Question 1
Soit la fonction f définie sur ]0 ; +oo[ par f(x) = 5x2− 2x + 8 ln(x) .
Calculer l’image de 1 par la fonction f.
f(1) = 5-2+0 = 3.
Question 2
Soit la fonction f définie sur ]0 ; +oo[ par f(x) = 5x2− 2x + 8 ln(x) .
On admet que la fonction f est dérivable sur l’intervalle ]0 ; +oo[ et on note f ' sa
fonction dérivée.
Calculer f '
(𝑥).
f '(x) = 10 x-2 +8 /x.
Question 3
On donne le nombre 𝐴 suivant : A =
e
−12
/ e
3
.Écrire A sous la forme ek où k étant un nombre entier relatif.
A = e-12 x e-3 = e-15.
Question 4
On considère l’équation différentielle (𝐸) ∶ y′ = 3y − 12, où y est une fonction de
la variable x, dérivable sur R.
Montrer que la fonction f définie pour tout réel x par f(x) = 4e3𝑥 + 4 est
solution de l’équation différentielle (𝐸).
f '(x) = 12e3x. Repport dans (E) :
12e3x=3(4e3𝑥 + 4)-12 = 12e3x est vérifiée quel que soit x.
Exercice 5. 5 points.
Les acides a-aminés sont des acides aminés dans lesquels les deux groupements
caractéristiques (– COOH) et (– NH2) sont portés par le même atome de carbone, appelé
carbone a. Dans la plupart des acides a-aminés, le carbone a porte également un atome
d’hydrogène et un groupement noté R, appelé « radical ».
1. Nommer les fonctions chimiques associées aux groupes caractéristiques (– COOH) et
(– NH2).
-COOH : acide carboxylique et NH2 amine.
La glycine est le plus simple des acides a-aminés puisque le radical R est un atome
d’hydrogène.
2. Expliquer la raison pour laquelle la glycine est une molécule non chirale.
Le carbone a ne porte pas 4 atomes ou groupes d'atomes différents.
L’alanine est un acide a-aminé dans lequel le radical R est un groupe (– CH3). L’alanine
est une espèce amphotère. La molécule d’alanine est représentée.
3. Classer les groupes liés au carbone asymétrique à l’aide des règles de Cahn, Ingold
et Prelog puis justifier qu’il s’agit de la configuration (S) de l’alanine.
4. Représenter l’autre énantiomère de la molécule d’alanine en perspective de Cram puis
indiquer la configuration absolue de cet énantiomère.
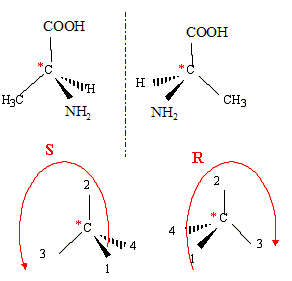
Outre des caractéristiques stéréo-isomériques, l’alanine possède des
propriétés acidobasiques particulières. Elle intervient, en solution
aqueuse, dans les deux couples acide-base suivants :
+H3N − CH(CH3
) − COOH / +H3N − CH(CH3
) − COO-
p𝐾𝑎1 = 2,4 à 20 °C.
+H3N − CH(CH3
) − COO-
/ H2N − CH(CH3
) − COO-
p𝐾𝑎2 = 9,7 à 20 °C.
5. Associer, en justifiant votre réponse, le caractère acide ou basique de chacune des
trois espèces intervenant dans les couples acide-base de l’alanine.
+H3N − CH(CH3
) − COOH, acide prédominant à pH <2,4.
+H3N − CH(CH3
) − COO- amphotère prédominant à pH compris entre 2,4 et 9,7.
H2N − CH(CH3
) − COO-, base prédominant à pH >9,7.
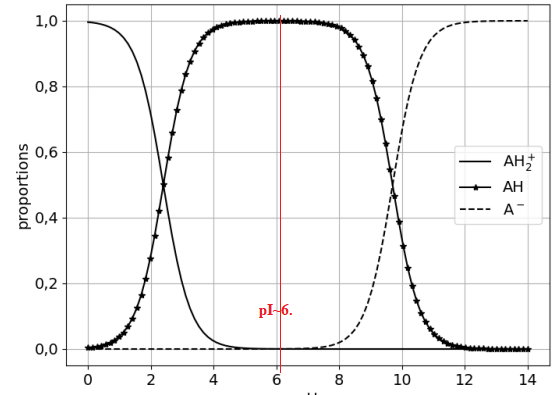
Le diagramme de distribution de l’alanine est présenté. Le diagramme de
distribution représente la proportion de chacune des trois espèces intervenant dans les
couples acide-base en fonction du pH.
6. Associer les notations AH
2+, AH et A
− aux trois espèces chimiques intervenant dans
les couples acide-base de l’alanine.
AH
2+: +H3N − CH(CH3
) − COOH.
AH : +H3N − CH(CH3
) − COO-.
A- : H2N − CH(CH3
) − COO-.
7. Donner la formule de l’espèce de l’alanine majoritairement présente dans un lait dont
le pH vaut 6,6 à la température de 20 °C.
A pH compris entre 2,4 et 9,7, l'espèce AH prédomine.
Afin de caractériser certains acides aminés, le concept de point isoélectrique ou potentiel
hydrogène isoélectrique nommé pI est communément utilisé au laboratoire de biochimie.
On le définit comme le pH pour lequel la « charge électrique nette » de la molécule est
nulle.
8. Justifier que, parmi les espèces chimiques impliquées dans les couples acide-base
dans lesquels intervient l’alanine, la formule de l’espèce chimique ayant une
« charge électrique nette » nulle est : +H3N − CH(CH3
) − COO-.
Il y a une charge positive portée par l'azote et une charge négative portée par l'oxygène : la charge globale est donc nulle.
9. À l’aide de la figure 6, déterminer le point isoélectrique pI de l’alanine.
pI = ½(pKa1 +pKa2) = ½(2,4 +9,7) =6,05.
Une électrophorèse consiste à déposer, sur un support fixe, un échantillon d’une solution
afin de le soumettre à l’action d’un champ électrique. La ligne de dépôt est repérée par
un trait de couleur noire. Sous l’effet du champ électrique E , on observe une migration de
la tache grisée obtenue par le dépôt de l’échantillon. Le résultat de l’électrophorèse d’une
solution d’alanine réalisée à trois valeurs différentes de pH est présenté.
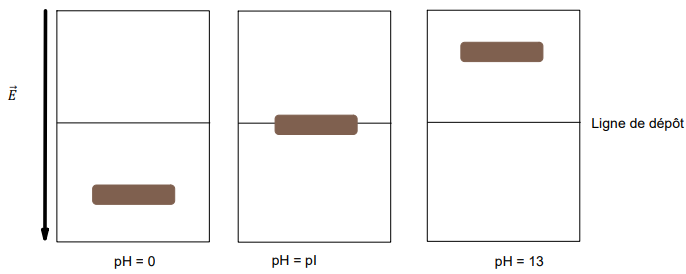
10. Donner la raison pour laquelle aucune migration de tâche n’est observée dans le
cas où pH = pI.
A pH = pI la molécule est globalement neutre. Elle ne subit pas l'influence du champ électrique.
|
|
|
|