Exercice 2 5 points
Dans cet exercice, on s’intéresse à une pile à combustible au
bioéthanol. Elle permet d’alimenter
des bornes de recharge de voitures électriques. Ce modèle de pile à
combustible est dit à oxydes
solides (ou SOFC selon l'acronyme anglais de solid oxide fuel cells).
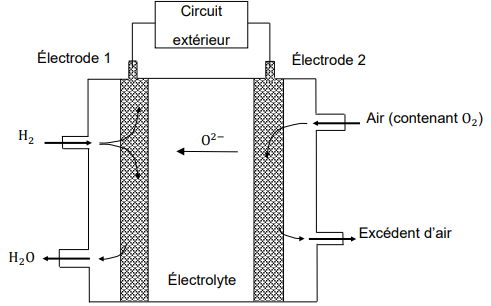
Comme le montre la figure , au niveau de l’électrode 2, le dioxygène présent dans l'air est
transformé en ion oxyde (O
2-). Les ions diffusent dans l’électrolyte et réagissent avec le
dihydrogène, obtenu par vaporeformage d’éthanol, au niveau de l’électrode 1. Au niveau de
l’électrode 1, la transformation est modélisée par une réaction électrochimique d’équation suivante H
2 + O
2- --> H
20 + 2e
- .
Données :
- masses molaires atomiques : M(C) = 12,0 g / mol ; M(H) = 1,0 g / mol
; M(O) = 16,0 g / mol
;
- constante d’Avogadro : N
A = 6,02 × 10
23 mol
-1 ;
- charge électrique élémentaire : e = 1,60 × 10
-19 C
- constante de Faraday : F = 9,65 × 10
4 C⋅mol
-1
;
- énergie stockée dans une pile (en joule) : E= Q U où Q est la capacité électrique de la pile
en coulomb (C) et U la tension à vide en volt (V) à ses bornes ;
- 1 Wh = 3600 J ;
- tension à vide de la pile à combustible étudiée : U = 1,0 V ;
- densité de l’éthanol : d
éthanol = 0,789 à 25 °C ;
- masse volumique de l’eau :
r = 1,00 g cm
-3 à 25 °C.
Le vaporeformage de l’éthanol consiste à transformer de l’eau et de l’éthanol en dihydrogène et en
dioxyde de carbone en présence d’un catalyseur. Cette transformation est modélisée par une
réaction dont l’équation est écrite ci-dessous.
C
2H
5OH (ℓ) + 3 H
2O (g) --> 6 H
2 (g) + 2 CO
2 (g).
Cependant, de nombreuses autres transformations sont possibles d’où la nécessité d’avoir un
catalyseur très actif et extrêmement sélectif pour ne produire que du dihydrogène et du dioxyde de
carbone à partir de l’éthanol. Dans la suite, on suppose que la conversion d’éthanol en dihydrogène
est totale.
Q1. Rappeler la définition d’un catalyseur.
Un catalyseur accélère une réaction thermodynamiquement possible. Il
est régénéré lors de la dernière étape du mécanisme et n'apparaît pas
dans le bilan.
Q2. Montrer que dans un volume de 1,0 L, la valeur de la quantité d’éthanol présente est voisine de 17 moles.
Masse d'éthanol : m=789 g.
M = 2 x12 +6 +16 = 46 g / mol.
n = m / M = 789 / 46~17 mol.
Q3. En déduire la valeur de la quantité de dihydrogène obtenue lors du vaporeformage d’un litre
d’éthanol, la vapeur d’eau étant en excès.
n(H
2)=6 x17 =102 mol.
Q4. Établir l’équation de la réaction électrochimique modélisant la transformation prenant place au
niveau de l’électrode 2.
O
2(g) + 4e
- --> 2O
2-(aq).
Q5. En déduire l’équation de la réaction modélisant le fonctionnement de la pile.
Electrode 1 : 2H2 + 2O2- --> 2H20 + 4e- .
Electrode 2 : O2(g) + 4e- --> 2O2-(aq).
Additionner : 2H2 (g)+ 2O2-(aq) +O2(g) + 4e---> 2H20(l) + 4e- +2O2-(aq).
Simplifier : 2H2 (g)+O2(g)-->2H20(l).
Q6. Indiquer, en justifiant, la polarité des deux électrodes de cette pile et les nommer.
Electrode 1 : oxydation du dihydrogène ; anode négative.
Electrode 2 : réduction du dioxygène ; cathode positive.
Q7. Indiquer cette
polarité ainsi que le nom et le sens de circulation des porteurs de charge à l’extérieur de la
pile.
Q8. Montrer que la valeur maximale de la capacité électrique de la pile étudiée utilisant 1,0 L
d’éthanol est Q
max = 2,0 × 10
7 C.
Q
max = n(e
-) F ; n(e-)= 2 n(H2) = 102 x2 =204 mol ;
Qmax = 204 x 9,65 10
4 ~
2,0 × 107 C.
.
Le rendement de la pile à combustible SOFC est voisin de 70 %.
Q9. Estimer le nombre de véhicules électriques équipés de batteries de 40 kW·h que l’on peut
recharger à partir d’un volume de 30 m
3 d’éthanol.
E = Qmax U x rendement=2,0 107 x1 x0,7 =1,4 107 J.
ou bien 1,4 107 / 3600 =3,9 103 Wh = 3,9 kWh à partir de 1 L d'éthanol.
3,9 x 30 103~1,2 105 kWh à partir de 30 m3 d'éthanol.
1,2 105 / 40 ~ 3 000 voitures.