Chimie.
Concours
technicien de la police
technique et scientifique. Zone ouest 2024
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| ... |
.
.
|
|
...
|
..
..
......
...
|
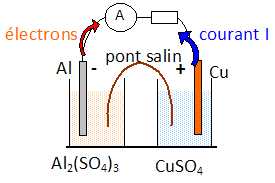 Q1. Un oxydant est une espèce capable de capter un ou plusieurs électrons. Réponse B.
Q1. Un oxydant est une espèce capable de capter un ou plusieurs électrons. Réponse B.
Q2. Les espèces consommés lors du fonctionnement sont :
Oxydation de l'aluminium à l'anode négative : Al(s) = Al3+aq
+ 3e-.
Réduction à la cathode positive : Cu2+aq + 2e-
= Cu(s).Réponse B.
Q3.
La cathode d'une pile correspond au pole positif siège d'une réduction. Réponse A.
Q4. Un potentiel standard E° fort implique la présence dans le couple redox d'un oxydant fort et d'un réducteur faible..
Réponse D.
Q5 .La demi équation du couple Al3+aq / Al(s) est :
Al(s) = Al3+aq
+ 3e-.
Réponse C.
Q6. La tension à vide de cette pile est égale à environ :.
E°(Al3+aq/Al(s) )= -1,66 V ; E°(Cu2+aq / Cu(s))=0,337 V
0,337 -(-1,66 )~2,00 V. Réponse A.
Q7. Le pont salin a pour rôle :
d'assurer l'électroneutralité des demi-piles en libérant des ions.
Réponse B.
Q8
On branche cette pile à un circuit électrique dans lequel on mesure une
intensité I = 0,3 A. Quelle serait la durée de la pile dans ces
conditions ?
Q =1,96 103 C.
Q = I t ; t = Q / I = 1,96 103 / 0,3 =6533 s ou 109 minutes.
Acide formique.
On réalise le titrage par suivi pHmétrique de 10 mL d'une solution d'acide formique par une solution de soude de concentration Cb = 1,00 10-2 mol / L.
Q9. Une réaction support d'un titrage doit être rapide, unique et totale.
Réponse A.
Q10.
Avant l'équivalence la quantité de matière nt( CH2O2) à un instant t est égale à :
n0( CH2O2)-V Cb avec V volume de soude ajouté.
Réponse D.
Q11 .Après l'équivalence la quantité de matière nt( CH2O2) à un instant t est égale à zéro.
.Réponse C.
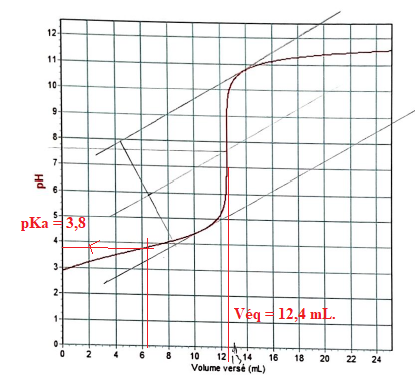
Q12. La concentration de l'acide formique est Ca =Cb Véq / V =1,00 10-2 x12,4 / 10 ~1,3 10-2 mol / L. :
. Réponse C.
Q13. Par lecture graphique le pKa de l'acide formique est environ :
pKa = pH de la demi-équivalence ~3,8. Réponse B.
Q14. La constante d'acidité Ka du couple CH2O2aq / CHO2-aq est la constante de l'équation :
CH2O2aq +H2O(l) =H3O+aq + CHO2-aq.
Réponse C.
Q15.
Ka = [H3O+aq][CHO2-aq] / ([CH2O2aq] c°). Réponse D.
Q16. Une valeur de pKa élévé implique la présence dans le couple d'un acide faible et d'une base forte. Réponse D
Respiration.
Lors de la respiration l'oxygène de l'air réagit avec le glucose C6H12O6 pour former de l'eau , du dioxyde de carbone et de l'énergie. On étudie la dégradation de 4,0 10-15
g de glucose dans une cellule humaine. Concentration initiale du
glucose dans la cellule 1,0 g / L. Cette cellule est alimentée par une
veine possédant une concentration en dioxygène de 4 mmol / L.
M(glucose) = 180,1 g / mol.
Q17. L'équation de réaction de respiration est : C6H12O6 aq + 6O2(g) -->6CO2(g) + 6H2O(l)
Réponse C.
Q18. Le réactif limitant est :
Glucose : 1,0 / 180 =5,55 10-3 mol / L =5,55 mmol / L.
Dioxygène=4 mmol/L.
4 / 6 = 0,66 ; une mmol de glucose réagit avec 6 mmol de dioxygène.
5,55 mmol de glucose réagit avec 5,55 x6 mmol de dioxygène. Ce dernier est en défaut.
Réponse B.
Q19. La respiration est une réaction de combustion du glucose.
Réponse C.
Q20. Du point de vue thermodynamique cette réaction est exothermique.
Elle dégage de l'énergie utilisée par les muscles. Réponse A.
|
... = =
|
....
|
Q21. La quantité de quatière de glucose étudiée est de :
m / M(glucose) =4,010-15 / 180=2,2 10-17 mol.
. Réponse B.
Q22. Pour faire réagir l'intégralité du glucose étudié, il est nécessaire d'utiliser le dioxygène présent dans :
2,2 10-17 x6 =1,3 10-16 mol =1,3 10-13 mmol de dioxygène.
1,3 10-13 / 4 =3,3 10-14 L = 33 10-15 L = 33 fL.
. Réponse C.
Q23. Un catalyseur a pour but d'accélérer la vitesse de la réaction. Réponse D.
Q24. La vitesse de disparition du glucose correspond à :
v = - d[gucose ] /dt. Réponse D.
Q25. Si on considère la réaction étudiée comme une réaction d'ordre zéro avec k = 6,2 10-8 mol L-1 s-1 son temps de demi-réaction est :
v = -dC /dt = constante = k.
C = C0-kt ; t½ =0,5C0 / k = 0,5 x5,55 10-3 /(6,2 10-8)=4,5 104 s
. Réponse B.
Soufre.
Q26. Des isotopes sont des noyaux ayant le même nombre de protons mais un nombre de neutrons différents.
Réponse D.
Q27. La notation symbolique du soufre 32 est :3216 S.
Réponse A.
Q28. La masse d'un atome de soufre 32 est : 32 10-3 /(6,02 1023)=5,3 10-26 kg.
Réponse D.
Q29.La configuration électronique de l'ion S2- est : 16+2 = 18 électrons.
1s2 2s2 2p6 3s2 3p6.
Réponse B.
Q30. La position de l'élément soufre dans le tableau périodique est : colonne 16 période 3. Réponse D.
Q31. Le soufre 35 est un isotope radioactif artificiel. Sa désintégration conduit au chlore 35.
Temps de demi-vie t½ =87,32 jours.
Le soufre 35 subit une (des) radioactivité(s).
3516 S--> 3517 Cl+0-1 e + g. ( type ß-)
Réponse C.
Q32.
Le temps de demi-vie d'une espèce radioactive correspond au temps
nécessaire pour que la moitié des noyaux initiaux soit désintégré. Réponse C.
Q33.
La constante radioactive du soufre 35 est :
l t½ = ln(2) ; l =ln(2) / (87,32 x24 x3600)=9,2 10-8 s . Réponse A.
Q34.
Un échantillon de soufre 35 contient 1,0 1018 noyaux. Déterminer le temps au bout duquel celui-ci ne contiendra plus que 1,0 1010 noyaux.
Loi de décroissance radioactive : N = N0exp(-lt).
1,0 1010 / (1,0 1018) =10-8 =exp(-9,2 10-8 t) ; t = -ln(10-8) / (9,2 10-8)=2,0 108 s ou 2,3 104 jours ou 6,35 ans.
Réponse D.
|
|
|
|