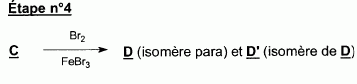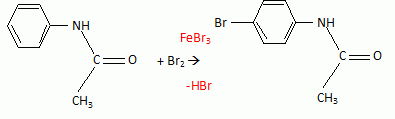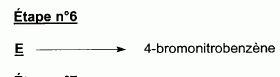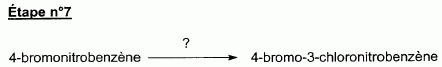|
Synthèse de l'aklomide, bac stl 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
|
|||||||
|
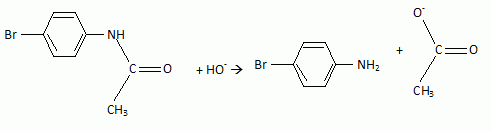
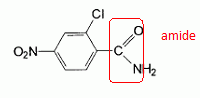
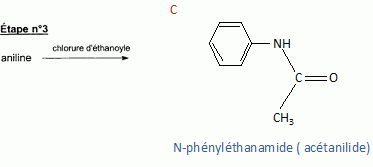
l'aklomide est le principe actif d'un médicament utilisé en médecine vétérinaire pour traiter certaines infections dues à un champignon. La formule semi-développée de cette molécule est la suivante : 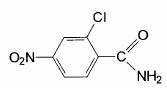 Ecrire l'équation de la réaction de l'étape 1. Donner la formule de l'agent électrophile qui intervient dans le mécanisme de cette étape. Seuls les composés organiques produits lors des différentes étapes sont notés dans les réactions. 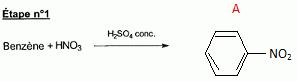 L'agent électrophile est l'ion nitronium NO2+. Ecrire l'équation de la réaction de A avec le zinc en milieu acide, sachant que le zinc métallique est oxydé en ion Zn2+. les demi équations électronique sont demandées. Zn = Zn2+ +2e- : oxydation du zinc. Réduction : C6H5 -NO2 + 7 H+ +6e- = C6H5 -NH3+ +2H2O. ( on note C6H5 -NH3+ : B ) 3 fois { Zn = Zn2+ +2e- } puis additionner. C6H5 -NO2 + 7 H+ +3Zn = 3Zn2+ +C6H5 -NH3+ +2H2O. Ecrire l'équation permettant d'obtenir l'aniline à partir de B. réaction acide base : C6H5 -NH3+ +HO- = C6H5 -NH2 +H2O. L'étape 3 est réalisée sans catalyseur : on obtient C de formule brute C8H9NO. Ecrire l'équation de la réaction et nommer le produit obtenu.
|
|||||||
| |
|||||||
|
|
 .
.