.
|
|
Equilibrer les
réactions suivantes :
TiO2 + 2Cl2
+ 2C ---> TiCl4
+ CO.
4 NH3
+ 5 O2 ---> 4 NO + 6 H2O.
ClO2 + H2O ---> HClO3 + HCl.
B2H6 + 3 O2
---> B2O3
+ 3 H2O.
2 Al + 3 Cu2+ ---> 2 Al3+ + 3 Cu.
2 N2O + O2
---> 4 NO.
Soit la réaction suivante :
CaCO3 (s) + 2HCl (aq) ---> CaCl2 (aq) + CO2
(g) + H2O (l).
Complétez
le tableau ci dessous en indiquant les quantités stoechimetriquements
associées à celle qui est indiquée sur chaque ligne.
On donne les masses
molaires : Ca: 40.08 g/mol, C 12.01, O15.99 Cl 35.45, H 1g/mol.
|
CaCO3
(s) |
+
2HCl (aq) |
--->
CaCl2 (aq) |
+ CO2
(g |
+ H2O
(l) |
quantité
de matière (mol)
|
0,06
|
0,12
|
0,06
|
0,06
|
0,06
|
masse
|
1
kg
|
729 g
|
1109 kg
|
440 g
|
180 g
|
M(CaCO3 (s))
=40,08 +12,01 +3*15,99 = 100,06 g/mol ; n(CaCO3 (s)) =
1000 / 100,06 =9,994 mol.
M(HCl) =
1 +35,45 = 36,45 g/mol ; n(HCl) = 2*9,994 =19,998 mol ; m(HCl) =
36,45*19,998 ~729 g.
M(CaCl2) =
40,08+2*35,45 = 110,98 g/mol ; n(CaCl2) = 9,994 mol ; m(CaCl2) = 110,98*9,994 ~1109 g.
M(CO2) = 12,01+2*15,99 = 43,99 g/mol ; n(CO2) = 9,994 mol ; m(CO2) = 43,99*9,994 ~440 g.
M(H2O) =
2+15,99 = 17,99 g/mol ; n(H2O) = 9,994 mol ; m(H2O) = 17,99*9,994 ~180 g.
On dispose de trois tubes contenant des solutions ioniques différentes.
Ces tubes, désignés par A, B et C, ont perdu leur étiquette indiquant
leur composition ionique. Des tests ont été réalisés afin de faire
correspondre une étiquette à un tube. Les trois étiquettes sont : (Cu2+,
SO42-) ; ( Zn2+, 2Cl-) et (Ca2+,
2Cl-). Les résultats des tests sont portés dans le tableau
suivant.
|
hydroxyde
de sodium
|
nitrate
d'argent
|
tube
A
|
précipité
blanc
|
précipité
blanc
|
tube
B
|
précipité
bleu
|
pas
de précipité
|
tibe
C
|
pas
de précipité
|
précipité
blanc
|
Le test positif au nitrate d'argent indique la présence d'ion chlorure.
Le test positif avec l'hydroxyde de sodium indique la présence d'un
cation métallique.
Tube A : ( Zn2+, 2Cl-) ; tube B : ( Cu2+, SO42-)
; tube C : (Ca2+,
2Cl-).
Pour le tube contenant (Ca2+, 2Cl-), indiquez
l’expérience à effectuer pour mettre en évidence les ions calcium
Ajout d'une solution d'oxalate d'ammonium : on observe un précipité
blac d'oxalate de calcium.
|
| .
. |
Renseigner la case
du tableau périodique ci-dessous.
 élément hydrogène ; n° atomique Z= 1 ; symbole H ;
masse atomique molaire 1,00794 g/mol. élément hydrogène ; n° atomique Z= 1 ; symbole H ;
masse atomique molaire 1,00794 g/mol.
Quelle
configuration électronique à cet élément ? Un électron externe (
1 s1).
Dans des conditions normales de température et de pression (0°C, 1 atm)
sous
quelle forme se présente le dihydrogène ? Gaz.
Hygiène sécurité.
Au cours d’une distillation de Tétrahydrofuranne sur sodium, un
incendie se déclare, quel type
d’extincteur utilisez-vous ? Sable
et extincteur à poudre.
Quels sont les
différents types d’extincteurs ?
Les feux sont classés en 4
classes: A : feux de solides ; B : feux de liquides ; C : feux de gaz ;
D : feux de métaux. On y ajoute les feux d'origine électrique E.
sable ( feu de métaux type D) ; seaux d'eau ( feu de solide type A ); extincteur à eau avec
additifs (feux
de liquides type B) ; extincteur à CO2 ( feu d'origine électrique) ; extincteur à poudre (
feu de
gaz).
Les
symboles suivants sont apposés sur les étiquettes des flacons de
produits chimiques. Quelle en est la
signification ?

1 : substance explosive ; 2 : danger pour l'environnement ; 3 :
substance comburante ; 4 : inflammable ; 5 : substance corrosive ; 6 :
substance toxique ; 7 : gaz sous pression ; 8 : subsatnce cancèrogène :
9 : danger, altère la santé.
Une
réaction de laboratoire doit être réalisée par combustion du «
Bioéthanol ». Une partie de l’étiquette de ce produit est reproduite
ci-dessous :
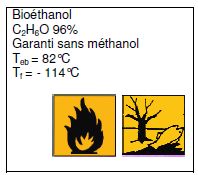
Compléter
le tableau ci-dessous concernant les pictogrammes présents sur
l’étiquette.
|
Signification
|
Principale
précautions à prendre
|

|
Substance
comburante
|
Tenir
éloigné de toute flamme
|

|
Danger
pour l'environnement
|
Ne
pas jeter à l'évier.
|
Indiquer la
température d’ébullition du bioéthanol : 82 °C.
Indiquer la température
de fusion du bioéthanol : -114 °C.
En déduire l’état
physique dans lequel se trouve ce produit s’il est stocké à 25°C.
Liquide.
Combustion de l’éthanol
dans le dioxygène de l’air. Ecrire la réaction.
C2H6O (l) + 3 O2(g) = 2 CO2(g)
+ 3 H2O(l).
|
|
 élément hydrogène ; n° atomique Z= 1 ; symbole H ;
masse atomique molaire 1,00794 g/mol.
élément hydrogène ; n° atomique Z= 1 ; symbole H ;
masse atomique molaire 1,00794 g/mol.


