|
QCM : oxydoréduction, solubilité, constante d'acicité, conductivité, chimie organique : concours kiné EFOM 2012. |
|||||||||
| .
. |
|||||||||
|
|||||||||
|
.
Oxydoréduction. On
connaît la valeur de la constante d'équilibre précédente à la
température ambiante K = 4,0 1014. On connaît : Quelle(s) est (sont) le(s)
affirmation(s) exacte(s) ? Spectrophotométrie.
Solubilité du sulfate de baryum. L'équation chimique de dissolution du sulfate de baryum solide s'écrit : BaSO4(s) = Ba2+aq + SO42-aq. La constante d'équilibre associée à cette réaction est K = 1,00 10-10 à 25°C. On définit la solubilité du sulfate de baryum comme étant la masse maximum de sulfate de baryum qu'il est possible de dissoudre dans 1 L d'eau à 25°C. M(Ba) = 137,3 g/mol ; M(S) = 32,1 g/mol ; M(O) = 16,0 g/mol. La solubilité du sulfate de baryum est :( en mg/L) :137,3 ; 2,33 ; 14,2 ; 6,50 ; autre valeur. K = [Ba2+aq][SO42-aq] ; la solution est électriquement neutre : [Ba2+aq]=[SO42-aq]= s ; K = s2 ; s = 1,00 10-5 mol/L ; M(BaSO4) =137,3 +32,1+64 =233,4 g/mol. s = 233,4*1,00 10-5 =2,33 10-3 g/L =2,33 mg/L. Polyaddition. Une polyaddition est possible si un monomère possède : A) Aucune liaison double. Faux. B) Une liaison double carbone carbone. Vrai. C) Une liaison double carbone oxygène. Vrai. Monomère possédant une insaturation. D) Un cycle aromatique analogue à celui du benzène. Faux. E) Aucune de ces affirmations. Constante d'acidité. Le vinaigre est une solution d'acide éthanoïque. On appelle Sc un vinaigre blanc du commerce. On prépare une solution diluée appelée Sd en prélevant avec une pipette jaugée, 10,0 mL de Sc que l'on verse dans une fiole jaugée de 100 mL. On complète jusqu'au trait de jauge avec de l'eau distillée, on bouche et on agite pour homogénéiser. On titre 10,0 mL de cette solution diluée par une solution d'hydroxyde de sodium ( soude ) de concentration en soluté apporté cB = 0,100 mol/L. A) La concentration cd s'écrit cd = c0/100 avec c0 la concentration en acide apporté de Sc. Faux. On effectue une dilution au dixième : cd = c0/10. B) L'équation chimique modélisant la réaction de l'eau avec l'acide éthanoïque s'écrit : CH3COOH aq + H2O = CH3COO- aq + H3O+aq. Vrai. C) La constante d'acidité du couple acide éthanoïque/ ion éthanoate s'écrit : Ka = [CH3COOH aq]éq / ([CH3COO- aq]éq[H3O+aq]éq). Faux. Ka = [CH3COO- aq]éq[H3O+aq]éq/ [CH3COOH aq]éq . D) L'équation chimique de la réaction support du titrage s'écrit : CH3COOH aq + HO-aq = CH3COO- aq + H2O. Vrai. E) On donne Ka = 10-4,8. On peut dire que la transformation précédente est totale. Vrai. K = [CH3COO- aq ] / ([CH3COOH aq][HO-aq]) =Ka / ([H3O+aq][HO-aq ] =Ka / Ke = 10-4,8 / 10-14 = 109,2. K est grand, la transformation est totale.
|
|||||||||
| Les anhydride d'acides : A) Sont des espèces dépourvue d'eau comme l'exemple suivant : 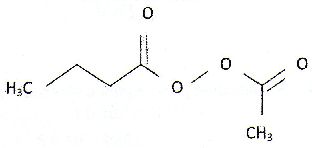 . Faux. . Faux.CH3-CH2-CH2-CO-O CO-CH3. B) Sont obtenus par hydrolyse basique d'un ester. Faux. Elimination d'une molécule d'eau entre deux molécules d'acide carboxyliques. C) Permettent la formation d'un ester plus rapidement qu'avec un acide carboxylique. Vrai. D) Sont des diacides. Faux. E) Interviennent comme réactifs dans la synthèse de l'aspirine. Vrai. Soit l'oxydation en milieu acide du peroxyde d'hydrogène par les ions iodures en excès : H2O2aq +2I-aq +2H+aq ---> 2H2O+I2aq. On note x l'avancement de cette réaction. On peut exprimer la vitesse volumique de réaction v : A) Comme la dérivée temporelle de l'avancement x. Faux. v = 1/V dx/dt avec V : volume de la solution. B) Comme la dérivée volumique de l'avancement x. Vrai. C) En divisant la pente de la tangente à l'origine de la courbe x(t) à l'instant initial par le volume de la solution. Faux. On calcule ainsi la vitesse initiale. D) La variation temporelle de l'absorbance du milieu réactionnel A550 étudiée à 550 nm, est de la forme : 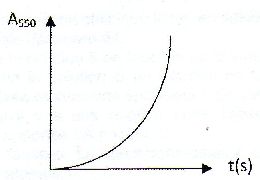 Faux. Faux.L'absorbance est due à l'un de produits, le diiode. L'absorbance croît et tend vers une limite finie. E) La variation temporelle de [I-aq] est de la forme : 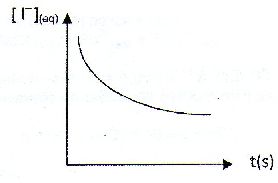 .Vrai. .Vrai.Les ions iodures, l'un des réactifs, sont en excès. |
|||||||||
|
|
|||||||||