|
|
|
|
Les
premiers matériaux utilisés en spintronique, dans les années 1995,
étaient des multicouches alternant un métal ferromagnétique et un métal
non magnétique, par exemple fer/cobalt ou fer/cuivre. Les avancées
technologiques en matière de croissance de films minces d’oxydes ont
favorisé le développement de recherches sur les oxydes ferromagnétiques
comme CoFe2O4
et multiferroïques
comme BiFeO3
plus efficaces pour le filtrage de spin que les métaux magnétiques.
Enfin, comme dans le domaine de l’électronique moléculaire, celui de la
spintronique moléculaire recherche des espèces chimiques possédant de
bonnes propriétés magnétiques. Sont explorées actuellement de
nombreuses voies de synthèse de complexes métalliques à base d’ions de
métaux de transition ou de lanthanides et de ligands organiques ; parmi
les complexes étudiés, nombre d’entre d’eux comportent plusieurs ions
métalliques et leurs assemblages forment des « clusters ».
Les
métaux magnétiques et non magnétiques des multicouches.
Les métaux sont étudiés en classe de troisième. Un professeur
distribue à ses élèves de troisième des caisses remplies d’objets
métalliques divers et leur propose l’activité suivante :
Le
ferrailleur vous propose de prendre le contenu de votre caisse pour 5
euros. Vous devez savoir si vous faîtes affaire avec lui ou non !
Expliquez
à l’écrit comment parvenir à identifier les métaux.
Fer et alliages :
utiliser un aimant pour les identifier.
Cuivre et laitons : couleur jaune à rouge.
Légereté : aluminium.
maléable et dense
: plomb.
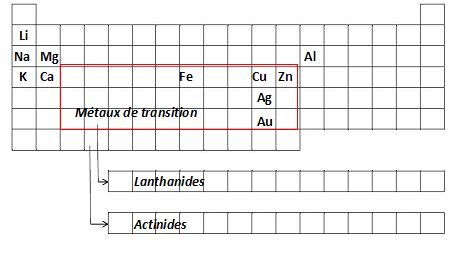
Nommer
les différentes familles de métaux. Placer ces familles et quelques
éléments de ces familles dans la classification périodique.
Métaux alcalins
: lithium, sodium, potassium ; alcalino-terreux : calcium,
magnésium ; métaux terreux
: bore, aluminium ; métaux
de transition : fer, cuivre, zinc argent, or ; lanthanides et
actinides.
Donner la
configuration électronique des atomes de fer et de cobalt.
26Fe
: 1s2 2s2 2p6 3s2 3p6
3 d6 4s2 ; 27Co
: 1s2 2s2 2p6 3s2 3p6
3 d7 4s2.
Le fer alpha cristallise en adoptant la structure cristalline centrée (
cc).
Faire
un schéma de la maille élémentaire et établir la relation donnant le
paramètre de la maille en fonction du rayon de l’atome de fer.
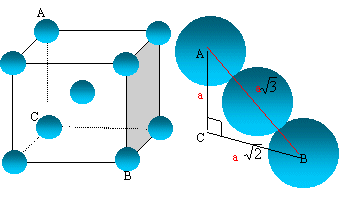
La
tangence
s'effectue suivant la grande diagonale du cube :
"a" racine carrée
(3) = 4 R ; R/a = 3½/4.
Déterminer la
compacité de la maille et conclure.
Les
atomes des
sommets apartiennent à 8 mailles et comptent pour 1/8 ; 1 atome central
:
8(1/8)+1 = 2 atomes par maille.
La
compacité
C, comprise entre
0 et 1, mesure le taux d'occupation de l'espace par les atomes ou les
ions assimilés à des sphères. C= volume occupé / volume de la maille.
volume
occupé : 2*(4/3pR3) ; volume de la
maille : a3 et R/a
=
racine carrée
(3) /4= 0,433.
C = 8/3 p
*0,4333 =0,68.
La structure cubique centrée est non-compacte.
|
.
|
Les oxydes
ferromagnétiques et multiferroïques.
Quels
sont les ions monoatomiques courants du fer, du cobalt, de bismuth et
de l’oxygène ?
Fe2+, Fe3+, Co2+, Co3+, Bi3+
et O2-.
Dans l’oxyde multiferroïque BiFeO3, quel est le degré
d’oxydation de l’ion fer ?
3 + x +3(-2) = 0 d'où x = +III.
Dans l’oxyde magnétique CoFe2O4, étudier les
différents degrés d’oxydation possibles du fer.
Si le nombre d'oxydation du cobalt est +II : 2 + 2 x+4(-2) = 0 d'où x =
+III.
Si le nombre d'oxydation du cobalt est +III : 3 + x + y+4(-2) = 0
d'où x = +IIIet y = +II.
La minette de Lorraine est un minerai constitué en partie d’hématite ou
oxyde de fer(III) Fe2O3. On se propose de
déterminer de deux manières différentes la teneur en fer dans la
minette de Lorraine.
Protocole donné à des olympiades
régionales de la chimie.
Pour faciliter sa pesée et sa mise en solution, l’échantillon de
minette de Lorraine a été finement broyé. Il a été, par ailleurs, séché
à l’étuve pendant plusieurs jours.
Etape 1 :
mise en solution
- Peser, exactement, une masse de minette de Lorraine de l’ordre de
0,120 à 0,130 g directement dans un erlenmeyer. Noter cette valeur pour
vos calculs ultérieurs.
- Ajouter 25 mL d’une solution d’acide chlorhydrique à 6 mol.L-1.
- Chauffer à « douce ébullition » jusqu’à dissolution complète du
minerai.
- L’élément fer se trouve alors essentiellement sous forme d’ions Fe3+.
- Laisser refroidir (au besoin sous un filet d’eau). On obtient la
solution S1.
Etape 2 :
réduction des ions Fe3+ : le titrage de l’élément fer se
faisant à partir d’ions Fe2+, les ions Fe3+sont
préalablement réduits par le zinc métal.
- Ajouter par petites quantités, environ 2 g de zinc métal à la
solution S1, tout en agitant.
- Tout le zinc doit disparaître ainsi que la coloration des ions .
Eventuellement, ajouter une petite quantité de zinc si la décoloration
n’est pas parfaite. On obtient la solution S2.
Etape 3 :
titrage des ions Fe2+: le titrage est réalisé par une
solution de dichromate de potassium de concentration molaire 1/120 mol.L-1,
en milieu acide et en présence de diphénylaminesulfonate de baryum
comme indicateur coloré.
- A la solution , ajouter 20 mL d’acide sulfurique de concentration
molaire 1 mol.L-1, 5 mL d’acide phosphorique commercial et
10 gouttes d’indicateur.
- Ajouter, à l’aide d’une burette graduée, la solution de dichromate de
potassium, la solution prend progressivement une teinte verte.
L’équivalence est observée lors du passage du vert au violet très
foncé. La teinte violette apparaît au cours du titrage et disparaît
très vite. Ajouter très lentement la solution de dichromate de
potassium au voisinage de l’équivalence.
- Noter le volume VE de solution de dichromate de potassium
versé à l’équivalence.
|
En les justifiant,
écrire les équations des réactions mises en jeu au cours des étapes 1,
2 et 3.
Etape 1 :
Fe (s)+ 3 H3O+aq ---> Fe3+ aq + 1,5
H2(g) +3 H2O.
Etape 2 : Fe3+ aq + 0,5 Zn(s) --->Fe2+ aq +0,5 Zn2+aq.
Etape 3 : Réduction de l'ion
dichromate : Cr2O72- +14 H+ +6e- =2 Cr3+ + 7H2O.(1)
Oxydation de Fe2+ : Fe2+ = Fe3+ + e- (2)
(1) + 6 fois (2) donne :
Cr2O72- +14 H+
+6e- +6Fe2+
=2 Cr3+ + 7 H2O+
6Fe3+ + 6e-
Cr2O72- +14 H+
+6Fe2+ = 2 Cr3+ + 7 H2O
+ 6Fe3+. (3)
Déterminer, en
explicitant votre raisonnement, la teneur
massique en fer de ce minerai lorrain. Pour un échantillon de
masse m=
0,122 g, le volume obtenu à l’équivalence est VE= 17,5 mL.
D'après les nombres
stoechiométriques, à l'équivalence, n(Fe2+)
= 6 n(Cr2O72-)
n(Fe2+)
= 6 /120*17,5 10-3 =8,75 10-4 mol soit une masse de fer égale à 8,75 10-4*55,8 =4,88 10-2 g.
Teneur en fer : 4,88 10-2
/0,122 =0,40 ( 40 %).
|
|

