|
|
|
|
Question 8.
On réalise une pile argent cuivre en associant :
- une demi-pile 1 constituée d'une électrode d'argent plongeant dans
une solution de nitrate d'argent.
- une demi-pile 2 constituée d'une électrode de cuivre plongeant dans
une solution de sulfate de cuivre (II).
On constate lors du fonctionnement de la pile que la solution dans
laquelle plonge l'électrode de cuivre est de plus en plus foncée. La
pile fonctionne durant 10 minutes et débite un courant d'intensité I =
100 mA.
On prendra 1 F = NA e ~ 105 C mol-1.
M(Cu) = 63,5 g/mol ; M(Ag) = 108 g/mol.
A) La demi-pile 1 est le siège d'une réduction. Vrai.
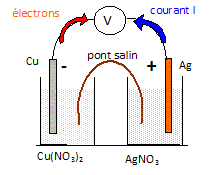
Oxydation du cuivre à l'anode négative :
Cu(s) = Cu2+aq
+ 2e-.
Réduction des ions argent
à la cathode positive : 2Ag+aq
+ 2e- = 2Ag(s)
Bilan : Cu(s) +2Ag+aq=
Cu2+aq
+
2Ag(s).
B) La demi-pile 1 est le siège d'une oxydation. Faux.
C) L'électrode d'argent constitue la cathode. Vrai.
D) Entre les deux demi-piles on utilise un fil
électrique pour faire la jonction. Faux.
E)
Durant le temps de fonctionnement de cette pile la variation de masse
de l'électrode de cuivre est Dm(Cu)
= 7,62 mg. Faux.
Quantité d'électricité :
Q = I t = 0,100 *10*60 = 60 C.
Quantité de matière
d'électrons : n(e-) = Q / F = 60 / 105
= 6 10-4 mol.
Quantité de matière de
cuivre : n(Cu) = ½n(e-) =3 10-4 mol.
La masse de cuivre diminue : Dm(Cu)
= -n(Cu) M(Cu) =
-3,10-4 *63,5 = -0,019 g ~ -19 mg.
F) Aucune proposition ne convient. Faux.
|
.
|
Question 9.
Le rouge de méthyle est un indicateur coloré acido-basique. Son pKa est
égal à 5,2. Sa teinte acide est rouge et sa teinte basique est jaune.
La formule topologique d'une des espèces présente dans cet indicateur
est :
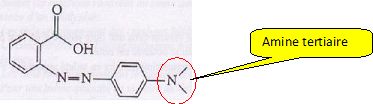
A) La molécule représentée donne une teinte rouge à la solution. Vrai.
On distingue le groupe
carboxyle -COOH présent en milieu acide, à pH < pKa.
A pH > pKa,
l'ion carboxylate serait majotitaire et la solution serait jaune.
B) La molécule présente une fonction amine secondaire. Faux.
C) La masse molaire de cette molécule est M = 268 g/mol. Faux.
Un nombre impair d'atome
d'azote donne une masse molaire impaire.
M(C15H15O2N3)
=15*12 +15 +2*16 *3*14 =269 g/mol.
D) L'indicateur coloré teinte une solution aqueuse de chlorure de
sodium de concentration c = 0,010 mol/L en rouge. Faux.
Une solution aqueuse de
chlorure de sodium a un pH neutre ( pH = 7 à 25 °C).
A pH supérieur au pKa
de l'indicateur coloré la forme basique prédomine et la solution est
teintée en jaune.
E) Lorsque l'indicateur coloré est dans un milieu de pH = 7,2, la
proportion de l'espèce acide est d'environ 1%. Vrai.
pH = pKa
+ log ( [A-] / [AH]) ; log ( [A-] / [AH]) = 7,2 -5,2 = 2 ; [A-] / [AH] = 100 ; [AH] = [A-]
/100.
F) Aucune affirmation correcte. Faux.
|
|
Question 10.
On considère une masse m d'éthanol. On mélange ce composé avec un excès
de dichromate de potassium acidifié. On obtient alors un composé
organique unique noté A. La masse obtenue est mA = 30 g.
Dans un ballon on introduit 30 g de A et 74 g de butan-2-ol. On
maintient une ébullition douce pendant une heure. On obtient alors un
composé B : l'éthanoate de 1-méthylpropyle. On suppose l'équilibre
atteint.
On prélève alors le dixième du milieu réactionnel et on le dose par
titrage avec une solution de soude de concentration c = 0,50 mol/L.
L'indicateur coloré utilisé est le BBT.
Il faut verser un volume V = 20 mL de soude pour que le BBT change de
couleur.
A) A est un
aldehyde, l'éthanal. Faux.
Un alcool primaire
conduit à un acide carboxylique en présence d'un excès d'oxydant. A est
l'acide éthanoïque.
B) La masse moaire de A est égale à 59 g/mol. Faux.
M(C2H4O2
) =2*12 +4+2*16 = 60 g/mol.
C) L'autre produit
obtenu lors de la réaction entre A et le butan-2-ol est de l'eau. Vrai.
acide carboxylique + alcool = ester + eau.
D) A l'équilibre il
reste 0,10 mol de butan-2-ol. Faux.
n(A) i = 30 /
60 = 0,50 mol ; n(butan-2-ol) i = 74 / 74 = 1,0 mol.
L'alcool est en excès.
On dose l'acide
éthanoïque restant à l'équilibre : n(A) restant = cV = 0,50
*0,020 =0,010 mol soit 0,10 mol de A dans tout le milieu réactionnel.
0,40 mol de A a donc réagi avec 0,4 mol de butan-2-ol : il reste donc
0,60 mol d'alcool à l'équilibre.
E) Le rendement de
la réaction est de 80 %. Vrai.
On calcule de rendement
par rapport au réactif en défaut, ici "A".
A partir de 0,50 mol de A on peut espérer obtenir au mieux 0,50 mol
d'ester ; or il ne s'en forme
que 0,40 mol.
F) Aucune proposition ne convient. Faux.
|
|

