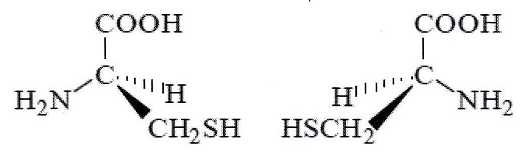|
|
|
|
Titrage
pH-métrique.
A)
Lors du titrage pH-métrique d'un acide faible par une base forte, le pH
du milieu réactionnel à la demi-équivalence est égal à la moitié du pH
à l'équivalence. Faux.
A la
demi-équivalence de ce titrage, le pH est égal au pKa
du couple acide faible / base conjuguée.
B) Lors du titrage pH-métrique d'un acide fort par une base forte, à
l'équilibre le pH vaut 7 à 25 °C. Faux.
A
l'équivalence de ce titrage, le pH vaut 7 à 25 °C.
C)
Lorsque les réactifs sont introduits en proportions stoechimétriques de
l'équation chimique de la réaction support du titrage pH-métrique, le
pH dépend de la température du milieu réactionnel. Vrai.
Le pH dépend
de la température.
D)
Lors du titrage pH-métrique d'une base forte par un acide fort, on peut
écrire, à l'équivalence du titrage : pH = ½pKe.
Vrai.
E)
Lors du dosage par titrage pH-métrique, il convient d'utiliser un
indicateur coloré de pH pour repérer l'équivalence, grâce au changement
de couleur du milieu réactionnel. Faux.
Le
changement de couleur d'un indicateur coloré permet de repérer
l'équivalence lors d'un dosage colorimétrique.
Question
2.
Soit la réaction d'équation CH3COOH aq +HO-aq
---> CH3COO-aq + H2O(l).
A) La constante d'acidité du couple acide éthanoïque / ion éthanoate
s'écrit :
Ka = [CH3COO-aq] /([CH3COOH aq][HO-aq]). Faux.
Ka = [CH3COO-aq][H3O+aq]
/([CH3COOH aq].
B) L'acide éthanoïque possède un
groupe caractéristique acide carboxylique. Vrai.
C) L'acide
éthanoïque ne possède pas de carbone tétraèdrique. Faux.
Le
carbone du groupe CH3- est tétraèdrique.
D)
Le dosage d'une solution d'acide éthanoïque par une solution
d'hydroxyde de sodium peut aussi être réalisé par titrage pH-métrique
que colorimétrique ou conductimétrique. Vrai.
On mélange 50,0 mL d'une solution d'acide éthanoïque de concentration ca
= 1,0 10-2 mol/L avec 25,0 mL d'une solution
aqueuse d'hydroxyde de sodium de même concentration apportée.
E) La solution obtenue est une
solution tampon de pH. Vrai.
On
se trouve à la demi-équivalence d'un dosage acide faible base forte, le
pH est égal au pKa du couple cide faible / base
conjuguée.
Question
3.
A) La représentation de Lewis d'une molécule permet la visualisation
dans l'espace decette molécule. Faux.
La
représentation de Lewis met en évidence les liaisons et les doublets
non liants.
B) La molécule de 1-bromo-1-chloroéthane ne possède pas de carbone
asymétrique. Faux.
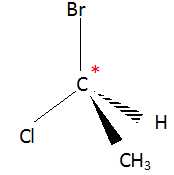
C) Il est possible de passer d'une conformation d'une molécule à une
autre par rupture de liaisons simples. Faux.
On passe
d'une conformation à une autre par rotation autour d'une liaison simple.
D) Un mélange racémique est un mélange de deux diastéréoisomères. Faux.
Un mélange
racémique est constitué de deux énantiomères en proportions identiques.
E) Deux énantiomères réagissent différemment avec des réactifs chiraux.
Faux.
Deux
énantiomères ont les mêmes propriétés chimiques.
|
.
|
Dissolution
du chlorure de cuivre (II).
Le chlorure de cuivre (II) est très soluble dans l'eau. A 25°C on peut
disoudre 700 g de ce cristal ionique anhydre dans un litre d'eau. Une
solution de cuivre (II) a une concentration en ion chlorure égale à
20,0 mmol/L. Sa concentration en ions cuivre (II) est :
A) 10 mmol/L. Vrai.
La solution
est électriquement neutre [Cl-] = 2 [Cu2+]
; [Cu2+]
= 20 / 2 = 10 mmol / L.
B) 40 mmol / L. Faux.
On veut préparer une solution de concentration [Cu2+aq]
= 20,0 mmol/L avec des cristaux de chlorure de cuivre (II), solide
hydraté de formule CuCl2, 2H2O.
Donnée : M(CuCl2) = 134,5 g/ mol. La masse de
solide à dissoudre pour obtenir 100 mL de solution est :
C)
0,341 g. Vrai.
Quantité de
matière de soluté = quantité de matière d'ion cuivre (II) = 20,0 10-3
*0,100 =2,00 10-3 mol.
M(CuCl2, 2H2O)
= 134,5 +36 = 170,5 g/mol.
Masse de
soluté : 2,00 10-3 *170,5 =0,341 g.
D) 0,269 g. Faux.
E) On utilise un bécher gradué de 250
mL pour fabriquer cette solution. Faux.
On utilise une
fiole jaugée de 100,0 mL.
Acides
a-aminés.
Les acides a-aminés
sont des constituants des protéines. Ils ont pour formule générale : H2N-CHR-COOH.
A) Ces molécules possèdent deux groupes caractéristiques : le groupe
amine et le groupe acide carboxylique. Vrai.
B) Les acides a-aminés
possèdent un caractère amphotère. Vrai.
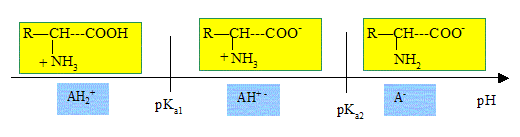
Le pH isoélectrique correspond
à une valeur particulière du pH d'une solution d'acide aminé. A cette valeur du pH la solution
possède un caractère amphotère.
La
kératine est le principal constituant du cheveu. C'est une protèine
formée à partir d'acides a-aminés dont l'un d'eux est la cystéine de
formule :
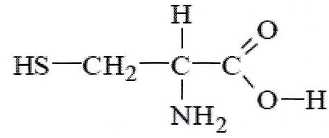
C) La cystéine est une molécule
achirale. Faux.
Cette
molécule possède un atome de carbone asymétrique.
D) Les représentations de Cram suivantes sont celles de deux
énantiomères de la cystéine. Vrai.
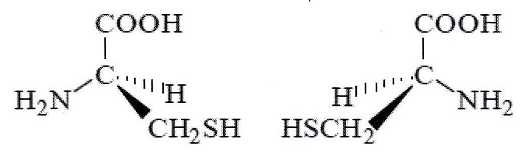
E)
La cystéine possède un atome de carbone de géométrie plane. Vrai.
L'atome de
carbone du groupe carboxyle.
|
|
Les ions iodures I- sont oxydés lentement par les ions peroxodisulfate S2O82-.
On peut étudier expérimentalement la cinétique de cette réaction en
dosant régulièrement le diiode formé, ce qui permet de tracer la courbe
[S2O82-aq] = f(t), donnant en fonction
du temps la concentration en ions peroxodisulfate restants. Une
première expérience, réalisée en présence d'ion Fe3+aq catalyseur à la température q1, permet de tracer la courbe ci-après.
A) La catalyse par les ions Fe3+aq est hétérogène. Faux.
Catalyseur et réactifs sont dans la même phase : la catalyse est homogène.
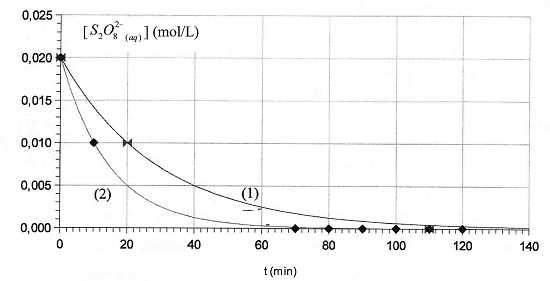
B) A t1 = 60 minutes, la concentration en diiode dans la solution est de 1,8 10-2 mol/L. Vrai.
[S2O82-aq]60 =2,0 10-3 mol/L d'après le graphe (1).
S2O82-aq + 2I-aq --> 2 SO42-aq + I2aq. [S2O82-aq]0 - [S2O82-aq]60 =[I2aq]60 =0,02 -2,0 10-3=0,018 mol/L.
On recommence la même expérience à une température q2 différente et on obtient la courbe (2).
C) q2 > q1. Vrai.
Le temps de demi réaction t½(2) = 10 min est inférieur à t½(1) =20 min.
D) q2 < q1. Faux.
E) La température du milieu réactionnel est un catalyseur de la réaction étudiée. Faux.
La température est un facteur cinétique.
|
|