|
|
|
|
Le
sujet de ce concours n'est pas accessible depuis ce site.
Q 61 : La lysine. Réponse D.
La lysine est un acide a-aminé comportant un groupe amine et un groupe carboxyle portés par le même carbone.
La lysine possède un atome de carbone asymétrique : d'où l'existence de deux énantiomères.
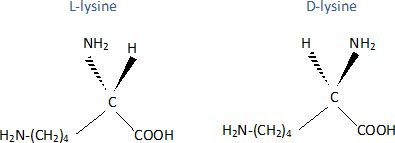
Q 62 : Composés oxygénés.
Réponse A.
L'absence de la bande fine et forte dans la région 1700 - 1750 cm-1
indique que la molécule ne possède pas de liaison C=O : l'acétate
d'éthyle, la butanone et l'acide acrylique ne sont pas à retenir.
La présence d'une bande fine et moyenne vers 1650 cm-1 prouve l'existence d'une liaison C=C : l'alcool ter-butylique n'est pas à retenir.
La présence d'une large bande vers 3400 cm-1 indique la présence du groupe O-H lié par liaisons hydrogène. On retient donc l'alcool allylique.
Q 63 : RMN.
Réponse D.
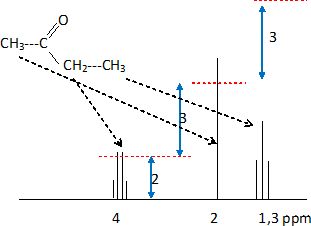 . .
Q 64 : Préparation d'une solution d'une base forte. Réponse B.
pH = 14 + log C ; log C = 10-14 = -4 ; C = 10-4 mol/L.
Quantité de matière (mol) = volume (L) fois concentration ( mol/L) =0,10*1,0 10-4 = 1,0 10-5 mol.
Masse molaire m = 40 g/mol ; masse à peser : 40 *1,0 10-5 = 0,40 mg = 400 µg.
Q65 : aspirine. Réponses B, D.
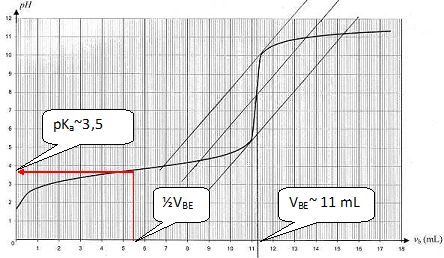
A l'équivalence n(aspirine ) = CB VBE =0,010 *11 10-3 =1,1 10-4 mol dans 20 mL.
Soit 1,1 10-4*500 /20 = 2,75 10-3 mol dans un comprimé.
M(aspirine) = 180 g/mol ; m = 180 *2,75 10-3 ~0,50 g.
Q 66 : Conductivité. Réponse E.
La conductivité de la solution est proportionnelle à sa concentration molaire :
s = 1,25 / 5,0 C= 0,25 C avec s en mS cm-1 et C en mmol L-1.
Concentration de la solution S : 1,5 / 0,25 = 6 mmol / L
Tenir compte du facteur de dilution : 6*100 = 600 mmol / L = 0,6 mol/L.
|
.
|
Q 67 : Conductivité. Réponse C.
Conductivité de la solution S à 20 °C : s30 =s20(0,025*10+1) =1,25 s20 ; s20 = 72,70 /1,25 =58,16 µS cm-1.
Concentration de la solution S : C = 58,16 /72,7 *100 =100 / 1,25 = 80 µg mL-1.
Q 68 : diiode. Réponse B.
I2 aq + 2S2O32-aq = 2I-aq + S4O62-aq.
Quantité de matière d'ion thiosulfate à l'équivalence : nthio =[S2O32-aq] VE =0,100 *7,8 10-3 = 7,8 10-4 mol.
Quantité de matière de diiode : ½nthio =3,9 10-4 mol dans 10,0 mL.
[I2 aq] =3,9 10-4 /0,010=3,9 10-2 mol/L.
Q 69 : Saponification de l'oléine.
Réponse D.
Oléine + 3 (Na+aq + HO-aq) ---> 3 oléate de sodium ( savon ) + glycérol.
Quantité de matière initiale d'oléine = m / M(oléine) = 88,4 / 884 = 0,10 mol.
Quantité de matière initiale de soude : 0,030 *10,0 = 0,30 mol.
Les réactifs sont en proportions stoéchiométriques.
On peut espérer obtenir au mieux 0,30 mol de savon. M(savon) = 304 g/mol.
Masse de savon : 304*0,30 ~ 91 g.
|
|
Q 70 : vert de bromocrésol. Réponses A, B, C, D.
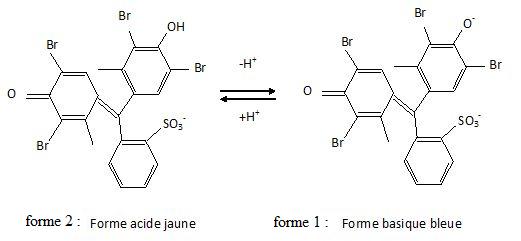
La
forme acide ( forme la plus protonée ) a un maximum d'absorption
dans le bleu et sa teinte est jaune, couleur complémentaire du bleu.
La forme basique a un maximum d'absorption dans le jaune et sa teinte est bleue.
Effet batochrome : le maximum d'absorption est déplacé vers les grandes
longueurs d'onde lorsque le nombre de doubles liaisons conjuguées
augmente.
La forme acide est majoritaire à pH < pKa ( 4,8). La forme basique est majoritaire à pH > pKa. Dans sa zone de virage, cet indicateur a une teinte verte.
|
|