Acidification des
océans : bac
S Nlle Calédonie 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Moules
et huitres menacées par l'acidification des océans.
Depuis le début de l'ère industrielle, les émissions anthropiques (1)
de dioxyde de carbone (CO2) dans l'atmosphère ont fortement
augmenté...
F.
Gazeau et ses collègues dont J P Gattuso, ont examiné la réponse des
huitres et des moules cultivées en France à l'acidification des océans.
Les résultats publiés dans la revue Geophysical Research Letters, sont
sans appel : ils montrent pour la première fois que ces mollusques
seront directement affectés par le boulversement en cours de la
composition chimique de l'eau de mer. Au delà de leur intérêt
commercial, les moules et les huitres rendent des services
écologiques très importants : elles créent par exemple des habitats
permettant l'installation d'autres espèces, contrôlent en grande
partie les flux de matière et d'énergie et sont d'importantes proies
pour les oiseaux au sein des écosystèmes qui les abritent. Un déclin de
ces espèces aurait donc des conséquences graves sur la biodiversité des
écosystèmes côtiers et sur les services qu'elles rendent aux
populations humaines.
(1) anthropiques : lié aux activités humaines.
D'après http:// www2.cnrs.fr/presse/communique/1054.htm et
http://www.sciences.gouv.fr/fr/actualites/bdd/res/2555/moules-et-huitres-menacees-par-l-acidification-des-oceans/
Acidification
des océans.
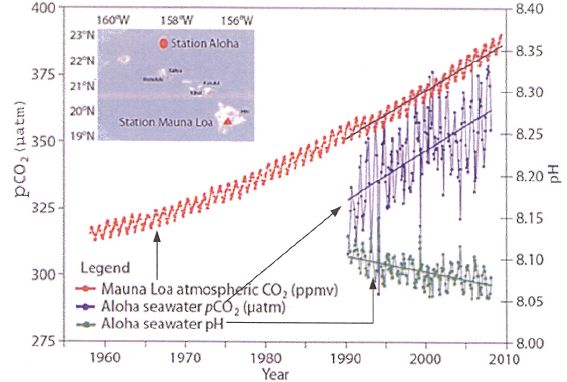
La
courbe 1 représente la concentration en dioxyde de carbone dans
l'atmosphère exprimée en ppmv ( partie par million par volume) n'est
qu'une indication de l'évolution de cette concentration psans souci
d'échelle.
Afin de comparer le contenu en CO2 de l'atmosphère et de
l'eau de mer, on définit la pression de CO2 dans l'océan : pCO2
= [CO2] / ß où ß est le coefficient de solubilité du CO2.
Que
peut-on dire des courbes ci-dessus ?
La concentration en CO2 dans l'atmosphère et la pression pCO2
dans les océans augmentent de la même manière depuis une vingtaine
d'années. En conséquence le pH des océans a diminué de 0,1 unité pH
durant cette période.
|
| .
. |
|
|
Document 2 : loi de henry.
La dissolution d'un gaz dans l'eau obéit à la loi de Henry selon
laquelle à température constante, la concentration C du gaz dissous est
proportionnelle à la pression partielle p qu'exerce ce gaz au dessus du
liquide.
A chaque instant un pourcentage constant des molécules du gaz dissous
dans la phase liquide repasse à l'état gazeux et s'échappe du liquide
mais dans le même temps le même pourcentage des molécules de ce gaz
passe en solution. Lorsque les deux flux se compensent,l'équilibre de
saturation est atteint, soit pour le dioxyde de carbone :
CO2(g) = CO2(aq).
Document 3 : réactions
d'équilibre des espèces carbonées.
CO2(aq) + 2H2O(l) = H3O+aq
+ HCO3-(1).
HCO3-+ H2O(l)
= H3O+aq + CO32-(2).
Montrer qu'une
augmentation de la quantité de dioxyde de carbone dans l'atmosphère
conduit à une diminution du pH de l'eau.
L'augmentation du dioxyde de carbone dans l'atmosphère déplace
l'équilibre CO2(g) = CO2(aq)
dans le sens direct.
CO2(aq)
augmentant, l'équilibre (1) est déplacé dans le sens direct ; il en est
de même pour l'équilibre (2).
En conséquence la quantité d'ion oxonium H3O+aq
croît et le pH de l'eau des océans diminue.
Montrer
qu'une diminution du pH de 0,1 au voisinage de 8,1, représente une
augmentation de la concentration en ion oxonium d'environ 30 %.
Concentration initiale (
en 1990) en ion oxonium dans l'eau de mer : C1 = 10-8,1
=7,94 10-9 mol/L.
Concentration
actuelle en ion oxonium dans l'eau de mer : C2 = 10-8,0
=1,0 10-8 mol/L.
C2 -C1
=2,01 10-9 mol/L soit 2,01 10-9 /(7,94
10-9 ) =0,26 ( 26 %).
|
.
Etude du mouvement du satellite
IBUKI.
Ce satellite lancé en 2009 étudie les gaz à effet de serre de
l'atmosphère qui contribuent à l'effet de serre. Il tourne autour de la
terre suivant une trajectoire circulaire qui passe au dessus des pôles
à l'altitude z = 667 km
Masse de la terre M =5,98 1024
kg ; rayon terrestre R = 6,38 103 km ; masse du satellite m
= 1,75 103 kg.
Représenter,
sans souci d'échelle, la terre, le satellite et la force d'interaction
gravitationnelle exercée par la terre sur le satellite supposé ponctuel.
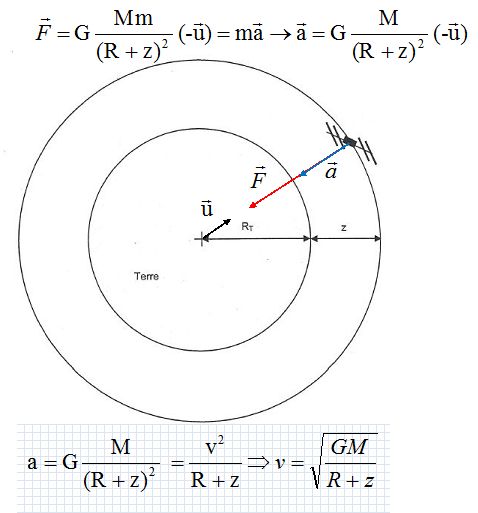
Calculer la valeur
de la période T de rotation du satellite autour de la terre.
Le satellite décrit la circonférence 2p(R+z)
à la vitesse v en T seconde.
v = [6,67 10-11 *5,98 1024 /(6,38 106
+667 103)]½ =7,5234 103 m/s.
T = 6,28((6,38 106 +667 103)
/ (7,5234 103)= 5,88 103 s ou 1
h38 min.
|
|