QCM de chimie
: sujet ASPF ( acueil, savoir, partage, francophonie) 2007
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Chaque exercice comporte 4 affirmations.
Indiquer pour chacune d'elles si elle est vraie (V) ou fausse (F).
Toute réponse exacte rapporte un point.
Toute réponse inexacte entraîne le retrait d'un point.
Exercice 1 : eau de Javel.
L’eau de Javel est un désinfectant, elle est fabriquée en solution aqueuse selon la réaction quasi-totale :
Cl 2(g) + 2 HO -(aq) = ClO -(aq) + Cl -(aq) + H 2O(l ) (réaction n° 1)
Le degré chlorométrique (°Chl) est le volume (exprimé en L) de dichlore
gazeux qui a été utilisé pour préparer un volume de 1,00 L d’eau de
Javel. Dans les conditions opératoires, le volume molaire gazeux est V m = 22,4 L.mol -1.
On considère de l’eau de Javel à 48,0° Chl.
Dans ces conditions, 60 L de dichlore gazeux sont nécessaires pour préparer 500 mL d’eau de Javel. Faux.
48 L de dichlore gazeux sont utilisés pour préparer un litre d'eau de Javel à 48°Chl ; 24 L de Cl2(g) sont utilisés pour préparer 0,5 L de cette eau de Javel.
La concentration molaire en ions hypochlorite ClO -(aq) est environ égale à 2,1 mol.L -1. Vrai.
Quantité de matière de dichlore = quantité de matière d'ion hypochlorite ClO-(aq)=48/ 22,4 =2,1 mol pour un litre de solution.
La teneur en ions hypochlorite ClO - (aq) diminue au cours du
temps, car les ions se transforment lentement en ions chlorure avec
dégagement de dioxygène selon l’équation bilan :
ClO -(aq) = Cl -(aq) + 1/2 O 2 (g) (réaction n° 2)
Cette réaction montre que le degré chlorométrique d’une eau de Javel
est susceptible de varier au cours du temps. On étudie la cinétique de
la réaction de décomposition. Deux séries d’expériences ont permis de
tracer les courbes suivantes :
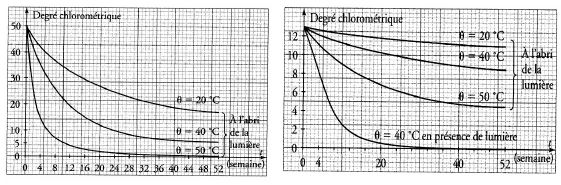
La température et l’absence de lumière sont des facteurs cinétiques faisant évoluer le système dans le même sens. Vrai.
Lors de sa fabrication, un berlingot d’eau de Javel contient 0,50 mol d’ions ClO -. Lors de son utilisation, six mois plus tard, il n’en contient plus que 0,48 mol. Le volume d’un berlingot est 250 mL.
La vitesse volumique moyenne de la réaction n° 2 est égale à 3 mol.L-1.mois-1. Faux.
Variation de la concentration en ion hypochlorite : (0,48-0,50) / 0,25 =-0,08 mol/L.
Vitesse moyenne de disparition de ces ions : 0,08 / 6 =0,013 mol L -1 mois -1.
|
| .
. |
|
|
Exercice 2 : ion permanganate et acide oxalique.
On réalise le mélange de V1 = 20,0 mL de permanganate de potassium (K+ + MnO4-) acidifié de concentration molaire en soluté apporté C1 = 2,00.10-3 mol.L-1 et V2 = 20,0 mL d’acide oxalique HOOC-COOH (solution incolore) de concentration molaire en soluté apporté C2 = 5,00.10-2 mol.L-1.
La réaction mise en jeu est lente et considérée comme totale, son équation est :
2 MnO4-(aq) + 5 H2C2O4(aq) + 6 H+(aq) = 2 Mn2+(aq) + 10 CO2(aq) + 8 H2O(l )
On suit son évolution par spectrophotométrie. On mesure l’absorbance A
du mélange réactionnel placé dans la cuve du spectrophotomètre. Dans
ces conditions, la concentration molaire en ions permanganate est
proportionnelle à la valeur de l’absorbance A mesurée. L’absorbance
A(t) et l’avancement de la réaction x(t) sont reliés par la relation :
x(t) = (2.10-5 A(t).10-5) mol.
Par un logiciel approprié, on obtient la courbe suivante :
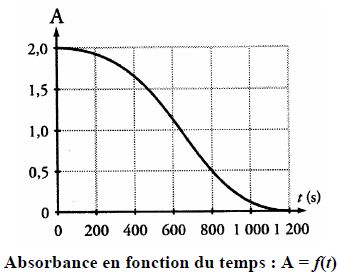
L’un des couples d’oxydoréduction mis en jeu dans la réaction chimique est CO2(aq)/H2C2O4(aq). Vrai.
Le temps de demi-réaction est égal à environ 650 s. Vrai.
C'est la durée au bout de laquelle l'absorbance initiale est divisée par 2.
On recommence l’expérience précédente en prenant le même volume V2 d’une nouvelle solution d’acide oxalique de concentration molaire apportée C2 = 2,50.10-3 mol.L-1.
La solution finale n’est plus incolore. Vrai.
Quantités de matière initiale : n(MnO4-(aq)) =C1V1 = 2,00 10-3*20 =4,00 10-2 mmol.
n(H2C2O4(aq)) =C2V2 = 2,500 10-3*20 = 5,00 10-2 mmol.
D'après les nombres stoéchiométriques, une mole d'ion permanganate réagit avec 2,5 moles d'acide oxalique.
0,04 mmole d'ion permanganate réagit avec 2,5*0,04 = 0,1 mmole d'acide oxalique. Ce dernier est donc en défaut. L'ion permanganate, seule espèce colorée, est en excès.
L’absorbance finale vaut 1.Vrai.
Excès d'ion permanganate : 2,00 10-2 mmol dans 40 mL.
Concentration finale de cet ion : 2,00 10-2 / 40 =5 10-4 mol/L.
Concentration initiale de cet ion : 4,00 10-2 / 40 =1 10-3 mol/L.
Absorbance initiale A =2 ; la concentration étant divisée par 2, l'absorbance finale vaut A=1.
|
.
|
|
Exercice 3 : l'acide borique.
L'acide borique H3BO3 est utilisé comme
antiseptique en solution aqueuse, par exemple dans les collyres. On
considérera ici qu'il s'agit d'un monoacide.
On souhaite réaliser un dosage pH-métrique de 20 mL d'une solution de
cet acide par une solution d'hydroxyde de sodium. La solution titrante
a une concentration de 1,0.10-2 mol.L-1.
On obtient les courbes suivantes donnant respectivement pH = f(V) et
pH' = dVdpH = g (V) qui font apparaître que le dosage ne peut pas être
effectué avec une très grande précision :
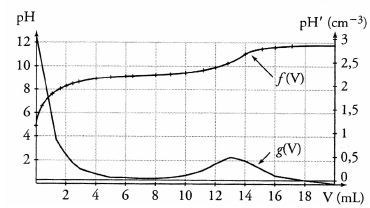
La base conjuguée de l'acide borique est BO2–. Faux.
H3BO3 = H2BO3- + H+.
On peut détecter l'équivalence avec la phénolphtaléine dont la zone de virage se situe entre pH = 8,2 et pH = 10. Faux.
Le pH du point équivalent est voisin de 11. La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent.
D'après le graphe, la valeur du pKa de l'acide borique est comprise entre 8 et 10. Vrai
pKa = pH à la demi-équivalence ( pour V = 6,5 mL).
La concentration molaire de la solution en acide borique a une valeur proche de 1,3.10-2 mol.L-1. Faux.
Quantités de matière à l'équivalence : n(HO-) = 1,0 10-2 *13,5 =0,135 mmol.
n( acide borique) = 20 [H3BO3] = 0,135 ; [H3BO3] =0,135/20=6,75 10-3 mol/L.
Exercice 4 : carbonate de calcium.
Dans les grottes, les concrétions (stalactites et stalagmites), constituées de calcaire CaCO3, peuvent se dissoudre en présence de dioxyde de carbone CO2 dégagé par la respiration des visiteurs.
L'équation de la réaction qui se produit est :
CaCO3 (s) + CO2(aq) + H2O = 2 HCO3–(aq) + Ca2+(aq)
La constante d'équilibre de cette réaction a pour valeur K = 3,5.10-6.
L'expression de la constante est : K =[HCO3–(aq)]2éq[Ca2+(aq)]éq / [CO2(aq)]éq. Vrai.
L'eau qui ruisselle sur les stalactites contient des ions calcium Ca2+, des ions hydrogénocarbonate HCO3– et du dioxyde de carbone aqueux. Les concentrations molaires initiales sont :
[CO2(aq)]0 = 1,0.10-2 mol.L-1 ; [HCO3–(aq)]0 = 8,0.10-4 mol.L-1 ; [Ca2+(aq)] 0 = 3,8.10-4 mol.L-1.
Le quotient initial de réaction est Qr, i = 3,0.10-5. Faux.
(8,0.10-4)2*3,8.10-4 /(1,0.10-2 )=2,4 10-8.
Dans ces conditions, c'est la réaction de dissolution du carbonate de calcium qui se produit. Vrai.
Qr, i < K, la réaction évolue dans le sens direct.
Le pH de la solution initiale est égal à 7,5. Faux.
Données : pH = pKa + log [base] / [acide]. Couple : CO2(aq), H2O/HCO3–(aq) : pKa = 6,4.
pH = 6,4 + log (8,0.10-4/10-2)=5,3.
|
|
Exercice 5 : électrolyse.
Le cadmium métallique est produit industriellement par électrolyse d'une solution acidifiée de sulfate de cadmium II (Cd2+ + SO42–). Cette électrolyse est réalisée sous une tension de 3,1 V.
On considère un électrolyseur qui produit une tonne de cadmium par 24 heures.
Données : Couples rédox pouvant intervenir dans l'électrolyse : Cd2+(aq)/Cd(s) ; H+(aq)/H2(g) ; O2(g)/H2O(l)
1 Faraday = 1F = 96,5.103 C.mol-1 ; Masse atomique molaire du Cadmium : MCd = 112,4 g.mol-1.
L'électrode où se forme le cadmium est reliée à la borne négative du générateur. Vrai.
La réduction se produit à la cathode négative.
Il se forme du dihydrogène à l'anode. Faux.
Oxydation de l'eau en dioxygène.
Il se forme du dioxygène à l'anode. Vrai.
L'intensité du courant a une valeur d'environ 2.104 A. Vrai.
Quantité de matière de cadmium : 106 / 112,4 =8,9 103 mol.
Quantité de matière d'électrons : Cd2+aq + 2e- = Cd(s). n(e-) = 2*8,9 103 =1,8 104 mol.
Q = 96,5.103 *1,8 104=1,7 109 C.
I = Q / t = 1,7 109/ (24*3600)=2 104 A
Exercice 6 : l'eugénol.
L'eugénol, extrait de l'huile essentielle des clous
de girofle ou des feuilles de giroflier, est utilisé dans certains
produits des domaines médical et dentaire en raison de ses propriétés
antalgiques et
antiseptiques. On peut également l'utiliser pour réaliser la synthèse
de la vanilline, molécule aromatique présente dans la vanille.
Données : Formules topologiques :
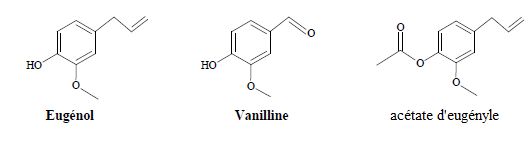
La vanilline est un ester de l'eugénol. Faux.
La vanilline possède une fonction aldéhyde. Vrai.
On réalise l'estérification par l'acide acétique d'une mole d'eugénol
et, après extraction, on récupère 103 g d'acétate d'eugényle
Masses molaires (en g.mol-1) : Eugénol : 164 ; Acétate d'eugényle : 206
Le rendement de la réaction est égal à 50%. Vrai.
A partir d'une mole d'eugénol, on peut récupérer au mieux une mole d'ester soit 206 g. Rendement = 103/206 = 0,50.
Il faut ajouter de l'eau au mélange réactionnel pour augmenter le rendement de la réaction. Faux.
L'ajout d'eau provoque l'hydrolyse de l'ester.
|
Exercice 7 : conductimétrie.
A 25°C, on étudie par conductimétrie la cinétique de l'hydrolyse
basique d'un ester RCOOR'. La quantité de soude introduite est 10 mmol.
L'ester est en excès.
En fin de réaction, la conductance Gf de la solution est de 9,1 mS. Le mélange réactionnel est très dilué.
Données : Conductivité molaire ionique ( S m2 mol-1) à 25°C :
lH3O+ =3,5 10-2 ; lHO- =2,0 10-2 ; lNa+ =5,0 10-3 ; lRCOO- =4,1 10-3.
Il s'agit d'une réaction totale. Vrai.
La conductivité du mélange réactionnel augmente au cours du temps. Faux.
ester + HO---> RCOO- + alcool R'OH.
Du point de vue de la conductimétrie, tout se passe comme si on remplaçait l'ion hydroxyde HO- par l'ion RCOO- de conductivité molaire ionique inférieure.
L'avancement final de la réaction est xf = 10 mmol. Vrai.
La conductance initiale de la solution est G0 = 25 mS. Vrai.
Gf = constante ( lNa++ lRCOO-) = 9,1 10-3 constante ; G0 =constante ( lNa++ lHO-) =2,5 10-2 constante.
G0 =Gf *2,5 10-2 /(9,1 10-3)=25 mS.
|
|