Cinétique,
alanine, menthol, menthone. Concours
Puissance 11 ( Fesic )
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Exercice
3.
Le tartre est essentiellement constitué d'un dépôt solide de carbonate
de calcium CaCO3. Lors du détartrage d'une
cafetière, l'acide lactique C3H6O3
contenu dans le détartrant réagit sur le tartre suivant la réaction
d'équation :
CaCO3(s)
+ 2 C3H6O3
aq ---> CO2(g)
+ Ca2+aq +2C3H5O3
-aq +H2O(l).
La quantité de matière de dioxyde de carbone formé est mesurée au cours
du temps. L'évolution de cette quantité de matière n en fonction du
temps est représentée ci-dessous :
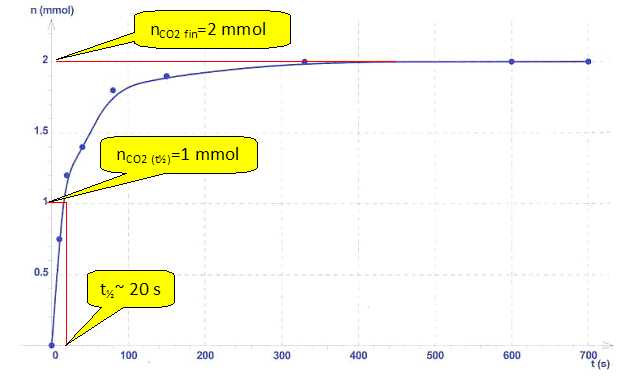
Données : le tartre est le réactif limitant ; la masse molaire
moléculaire de CaCO3 est : M= 100 g.mol-1.
a)
A l'état initial, la masse de tartre dans la cafetière est de 200 mg. Vrai.
n(tartre initial) = nCO2
fin = 2 mmol ; m(tartre) = n(tartre initial) M = 2*100 =
200 mg.
b) La durée de
détartrage est estimée à environ 6 min. Vrai.
c) Le temps de
demï-réaction est de 3 min. Faux.
d)
Une augmentation de la concentration molaire en acide lactique diminue
le temps de demï-réaction. Vrai.
La
concentration des réactifs est un facteur cinétique.
Exercice
5.
La L-alanine est l'un des 22 acides
aminés codés génétiquement. Elle est hydrophobe et est le deuxième plus
petit acide aminé parmi les 22 derrière la glycine. L'alanine est un
acide aminé non essentiel et a été isolée dès 1879. La dénomination
IUPAC est acide 2-aminopropanoïque ou acide a-aminopropionique.
On trouve également dans la nature l'énantiomère D-alanine, qui
participe en particulier à la construction du peptidoglycane, le
constituant principal de la paroi des bactéries. La D-alanine est
formée à partir de L -alanine
par I'action d'une isomérase, l'alanine racémase.
|
|
|
a) La L-alanine
contient un groupement acide et un groupement amide. Faux.
Un acide
alpha aminé contient un groupe carboxyle et un groupe amine portés sur
le même carbone.
b)
La L-alanine a pour formule topologique : Vrai.
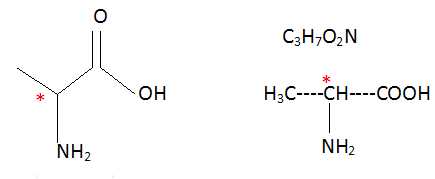
c)
La L-alanine possède un carbone asymétrique. Vrai.
d)
La masse molaire moléculaire de la L-alanine est égale à 89 g.mol-1.
Vrai.
M = 3*12+7+2*16+14 =89 g.mol-1.
|
.
|
|
Exercice
6.
Le menthol est un anesthésique local possédant des qualités
anti-inflammatoires. Il est largement répandu pour soulager
l'irritation mineure de la gorge.
Deux stéréoisomères du menthol sont représentés.
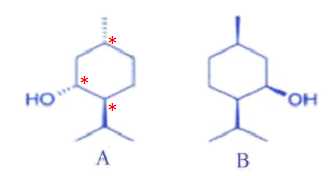
a)
Dans le stéréoisomère B, le groupe hydroxyle se trouve au-dessus du
cycle considéré comme plan. Vrai.
b) Le stéréoisomère
A possède plus de conformères que de diastéréosomères. Vrai.
Le cycle à
six atomes de carbone existe essentiellement sous deux conformations
stables, la forme chaise et la forme bateau ; entre les deux il y
a de nombreuses conformations instables obtenues par rotation autour
d'une liaison simple carbone- carbone, dans la mesure oùle cycle le
perme.
c)
Le menthol possède trois carbones asymétriques. Vrai.
d) Les
stéréoisomères A et B sont énantiomères. Faux.
|
|
|
Exercice
7.
La menthone est un des constituants de certaines espèces de menthe,
dont la menthe poivrée « Mentha piperita >>. Son odeur et
sa saveur fraîche, analogues à celles de la menthe, en font un arôme
très utilisé dans les produits alimentaires. La menthone est obtenue
par oxydation du menthol en milieu acide. Cette oxydation est réalisée
par l' ion permanganate MnO4-.
L'équation associée à cette réaction est :
2MnO4-(aq) + 5 C9H18CHOH(l)
+6H3O+ = 2Mn2+aq
+ 5 C9H18CO(l)
+14H2O(l).
On
se propose d'oxyder 15,6 g de menthol. Pour cela, on utilise un volume
V =100 mL de solution de pennanganate de poturriun. (K+(aq)
+ MnO4-(aq))
de concentration molaire c =0,800 mol/L, acidifiée de
quelques millilitres d' acide sulfurique concentré.
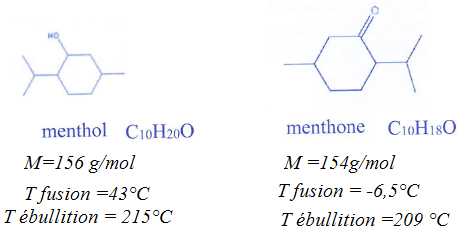
a) La menthone est
une cétone. Vrai.
b) A température
ambiante (20°C), la menthone et le menthol ont le même état physique.
Faux.
Le menhol
est solide ; la menthone est liquide.
c) A l'état initial,
le mélange est dans les proportions stoechiométriques. Faux.
n(menthol) =
15,6 / 156 = 0,10 mol ; n(MnO4-(aq)
)=Vc = 0,100 *0,800=0,080 mol.
D'après les
nombres stoechiométriques, 0,10 mol de menthol réagit avec 2*0,08 /5
=0,032 mol d'ion permanganate. Ce dernier est donc en excès.
d) En supposant la
réaction totale, la masse de menthone obtenue est de 15,4 g. Vrai.
A partir de
0,10 mol de menthol, on obtient 0,10 mol de menthone.
|
|
|