Acide
lactique : la molécule, RMN, titrage. Concours Geipi 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
L’acide lactique est
naturellement présent dans les organismes vivants. Il peut être obtenu
par synthèse, mais on peut aussi le préparer en quantités importantes
par fermentation bactérienne de polyosides d’origine végétale comme
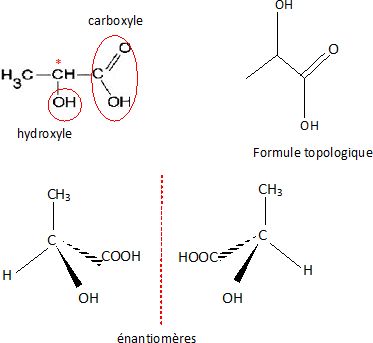
l’amidon. L’acide lactique a pour formule H3C-CH(OH)-COOH
; c’est un acide faible de pKa = 3,9.
Entourer
et nommer les groupements fonctionnels présents dans la molécule.
Indiquer
par une étoile (*) le ou les atome(s) de carbone asymétrique(s)
présent(s) dans la molécule :
Donner
la représentation de Cram des deux stéréoisomères de configuration de
l’acide lactique.
 Quelle
relation stéréochimique existe-t-il entre les deux molécules précédentes
?
Quelle
relation stéréochimique existe-t-il entre les deux molécules précédentes
?
Ce sont deux énantiomères.
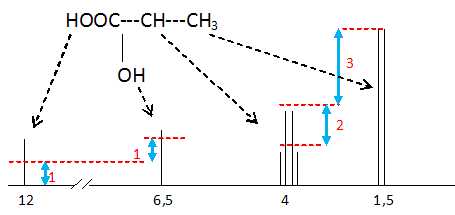
Le document réponse montre le spectre RMN du proton de
l’acide lactique ainsi que la courbe d’intégration pour les différents
pics de résonance. Sachant que les protons –COOH ont un déplacement
chimique compris entre 10 et 13 ppm et que celui des –OH se situent
dans ces conditions autour de 5 ppm, attribuer
les signaux aux atomes d’hydrogène présents dans la molécule en reliant
par un trait sur le spectre les groupes encadrés aux pics qui leur
correspondent.
Les trois protons du groupe méthyle
sont
équivalents et couplés avec le proton du carbone n°2 : doublet.
Le proton du carbone n°2 est couplé avec les trois protons du groupe
méthyle : quadruplet.
On observe deux singulets correspondants aux protons de la fonction
alcool et acide carboxylique.
|
| .
. |
|
|
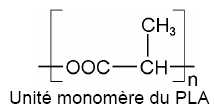
Le PLA (Poly Lactique
Acide) est préparé, comme son nom l’indique, à partir d’acide lactique,
lui-même tiré de la biomasse, ce qui lui vaut d’être classé parmi les
biopolymères.
La fabrication d’origine biologique et
renouvelable du PLA, sa biocompatibilité et sabiodégradabilité en font
dans certaines applications un concurrent intéressant des matières
plastiques « classiques » issues de produits pétroliers.
Nommer
la fonction chimique présente dans la chaîne macromoléculaire du PLA.
Fonction ester.
|
.
|
|
La dégradation du PLA est aisée,
puisqu’on peut le dépolymériser par simple hydrolyse en présence d’un
acide comme catalyseur. On reforme alors le monomère : l’acide lactique.
On place 7,20 g de copeaux de PLA, équivalant à 0,10 mol d’unité
monomère, dans 1,0 L d’une solution aqueuse d’acide sulfurique (de
formule H2SO4), que l’on
porte à reflux.
Après 8 heures de chauffage, on prélève un échantillon de V = 50,0 mL
du liquide. On procède alors à un dosage par une solution étalonnée de
soude de concentration [NaOH] = 0,10 mol.L-1,
que l’on suit par conductimétrie. La soude, en tant que base forte,
réagit d’abord sur l’acide sulfurique, que l’on considérera comme un
diacide fort.
La courbe s
= f(Vsoude) qui porte la conductivité en
fonction du volume de solution titrante versée montre deux points
anguleux : l’un ayant pour abscisse Ve1 = 15,0
mL et le deuxième
pour Ve2 = 45,0 mL.
Ecrire la réaction de neutralisation (1) de l’acide sulfurique par la
soude.
(2H3O+aq + SO42-aq
)+ 2(HO-aq +Na+aq)--->
2Na+aq +SO42-aq
+4H2O.
Ecrire la
réaction de neutralisation (2) de l’acide lactique par la soude.
CH3-CH(OH)-COOHaq + (HO-aq +Na+aq)
---> Na+aq +CH3-CH(OH)-COO-aq
+H2O
Donner les
variations de la courbe s
= f(Vsoude).
Du point de vue de la conductivité :
- avant la première équivalence, la soude est en défaut, tout se passe
comme si on remplaçait l'ion H3O+aq
par l'ion Na+aq, de
conductivité molaire ionique moindre : s diminue
fortement..
- après la première équivalence, la soude est en défaut, tout se passe
comme si on remplaçait la molécule CH3-CH(OH)-COOH
par les ions Na+aq et CH3-CH(OH)-COO-aq, la conductivié croît.
- après la seconde équivalence, la soude est en excès, la conductivité
molaire ionique de l'ion HO-aq étant
grande, s
croît fortement.
Calculer
la concentration d’acide sulfurique présent dans la solution d’hydrolyse.
A la première équivalence : 2n(H2SO4) = n(soude) = [NaOH] Ve1 ;
[H2SO4] =½[NaOH] Ve1 / V
=0,5*0,10*15,0 / 50,0 =0,015 mol/L.
Calculer
la concentration d’acide lactique présent dans la solution d’hydrolyse.
n(acide lactique) = n(soude) = [NaOH] (Ve2 -Ve1) ; [acide lactique] =[NaOH] (Ve2 -Ve1) / V
=0,5*0,10*30,0 / 50,0 =0,060 mol/L.
Quel est
le taux d’avancement de l’hydrolyse après 8h ?
D'après le texte :0,10 mol d'unité monomère dans 1 L soit dans 50 mL :
0,10*50/1000 =0,0050 mol.
Le titrage conduit à : 0,060*0,050 = 0,0030 mol d'acide lactique.
Le taux d'avancement de l'hydrolyse est donc de 0,003/0,005 = 0,6 (60
%).
|
|
|


