Autour du lithium : structure,
réaction avec l'eau, pile au lithium.
Concours interne d'ingénieur de l'industrie et des mines
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Structure.
Donner le nom de la
famille d'éléments à laquelle appartient le lithium. Connaissez-vous un
autre élément de la même famille ?
Lithium, sodium, potassium appartiennent à la famille des alcalins.
Comment
explique-t-on le caractère fortement réducteur du lithium ?
Le lithium est un métal d'électronégativité très faible ( 0,98 dans
l'échelle de Pauling ). Le lithium a peu d'affinité pour les électrons,
c'est donc un réducteur fort.
Pourquoi
le lithium métallique n'existe pas à l'état naturel ?
Le lithium réagit facilement avec l'air et l'eau. Du fait de sa grande
réactivité chimique le lithium n'existe pas à l'état naturel.
A température ambiante le lithium possède une structure cubique centrée.
Représenter
la maille cristallographique. Quelle est la coordinence du lithium
?
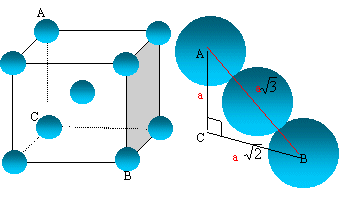
La coordinence
est le nombre de plus proches voisins d'une sphère quelconque, ces
voisins étant tangents à la sphère envisagée. Chaque atome de lithium
est au centre d'un cube, entouré de 8 autres atomes : coordinence = 8.
Déterminer
le paramètre de la maille, noté a, et en déduire la compacité ainsi que
la masse volumique. rLi = 152 pm.
La tangence s'effectue suivant la grande diagonale du cube : a racine carrée
(3) = 4rLi.
a = 4*152/1,732 = 351 pm.
Les 8 atomes situés aux sommets du cube sont communs à 8 mailles et
comptent pour 1/8=0,125.
celui du centre, commun à une seule maille, compte pour une unité.
nombre d'atomes de lithium appartenant à la maille : 8* 0,125 +1 = 2.
La compacité C,
comprise entre 0 et 1, mesure le taux d'occupation de l'espace par les
atomes ou les ions assimilés à des sphères. C= volume occupé / volume
de la maille.
volume occupé : 2*(4/3pR3) ;
volume de la maille : a3 ; et R/a = racine carrée (3) /4= 0,433.
C= 8/3p (R/a)3=8/3*3,14*0,4333
= 0,68
, structure peu compacte.
La masse volumique m
(kg m-3) est la masse d'une maille (kg) divisée par le
volume de la maille (m3).
Masse d'une maille : masse de deux atomes de lithium = 2*masse molaire
(kg) /nombre d'avogadro :
soit 2*6,94 10-3 / 6,023 1023 = 2,30 10-26
kg.
Volume d'une maille a3 = (351 10-12)3=
4,32 10-29 m3.
µ = 2,30 10-26
/ 4,32 10-29 =5,3 102
kg m-3.
Réaction sur
l'eau.
Le lithium solide décompose l'eau avec dégagement de dihydrogène.
Li(s)+H2O(l) ---> ½H2(g) + Li+aq +
HO-aq.
Exprimer
puis calculer l'enthalpie standard de réaction ainsi que l'entropie
standard de réaction.
DrH° =
½DfH° (H2(g)) +DfH° (Li+aq
+ HO-aq)-DfH° (Lis)
+DfH° (H2O(l)).
DrH° =0
+(-508)-0-(-285) = -223 kJ/mol.
DrS° = ½S° (H2(g)) +S° (Li+aq
+ HO-aq)-S° (Lis)
+S° (H2O(l)).
DrS° =0,5*131 + 2,7
-69,9-29,1 = -30,8 J K-1 mol-1.
|
| .
. |
|
|
En
déduire l'expression de l'enthalpie libre standard en fonction de la
température en se plaçant dans les conditions d'Ellingham. Calculer la
constante d'équilibre à 298 K et conclure.
DrG° =DrH°
-T DrS°= -223 103 -298 (-30,8) =-2,14
105 J mol-1.
ln K = -DrG°/(RT) =2,14 105
/(8,314*298) =86,3 ; K =3,0 1037.
K est très grand, la réaction est donc totale.
Ecrire
les équilibres des couples associés à la réaction, ainsi que leurs
potentiels électrochimiques.
Li+aq / Li(s) : Li(s) = Li+aq +e-.
E1 = E°(Li+aq / Li(s)) +0,059 log [Li+aq ].
H2O(l)
/ H2(g) : H2O(l)
+e- =½H2(g) +HO-aq.
E2 = E°(H2O(l)
/ H2(g)) +0,059 log(1/ ([HO-aq][P½H2)).
Relier la constante
d'équilibre aux potentiels et en déduire E°(Li+aq / Li(s)).
A l'équilibre : E1 =E2 et K = [Li+aq ][ HO-aq][P½H2).
E°(Li+aq / Li(s)) +0,059 log [Li+aq ] = E°(H2O(l)
/ H2(g)) +0,059 log(1/ ([HO-aq][P½H2)).
0,059 log [Li+aq ] -0,059 log(1/ ([HO-aq][P½H2)) =E°(H2O(l)
/ H2(g)) -E°(Li+aq / Li(s)).
0,059 log K =E°(H2O(l)
/ H2(g)) -E°(Li+aq / Li(s)).
E°(Li+aq / Li(s)) =E°(H2O(l)
/ H2(g))-0,059 log K = -0,83-0,06 log (3 1037)=-3,04
~-3,0 V.
|
.
|
|
Pile au lithium.
Ce
type de pile est constitué d'une borne positive en dioxyde de manganèse
et d'une borne négative au lithium ; l'électrolyte est un sel de
lithium LiPF6 dissout dans un solvant organique ( carbonate de propylène ) et concentré en ion Li+ ( milieu acide ).
Ecrire
les réactions intervenant à chaque électrode, la réaction globale, la
fem de la pile. Pourquoi l'électrolyte est-il un solvant organique ?
Oxydation du lithium à l'anode négative : Li(s) = Li+ + e-. (1)
Réduction de MnO2 à la cathode positive : MnO2 +H2O +e-= MnO(OH)+HO-.
MnO2 +H2O +Li(s) = MnO(OH)+Li++HO-.
E = E°(MnO2 /MnO(OH))-E°(Li+/Li) =1,01-(-3,04) =4,05 ~4,1 V.
Le solvant doit être inerte vis à vis des réactifs et ces derniers doivent être solubles dans ce solvant.
Une électrode au lithium a une masse de 2,0 g.
Déterminer
la quantité de matière de lithium disponible ainsi que le nombre de
moles d'électrons que peut transferer la pile. Quelle est la quantité
d'électricité Q ( en Ah) qu'elle peut fournir ? n(Li) = n(e-) = m / M = 2,0 / 6,94 = 0,288 mol.
Q = n(e-) F = 0,288*96500 =2,78 104 C ou 2,78 104 /3600 = 7,7 Ah.
Exprimer la capacité massique Cm ( Ah kg-1) de cette pile et comparer avec une pile au zinc.
Cm = Q / m = 7,7 / 0,002 =3,8 103 Ah kg-1.
C'est à dire 8 fois plus que dans une pile au zinc.
Quand la pile est-elle usée ? Calculer l'autonomie de la pile si le courant débité est 0,1 mA.
La
pile est usée quand l'un des réactif a disparu ( ou encore lorsque le
quotient de réaction atteint la valeur de la consatnte d'équilibre K.
t = Q / I = 2,78 104 / 10-4=2,78 108 s ou 8,8 ans.
|
|
|
