Pile,
concentration et absorbance.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Pile.
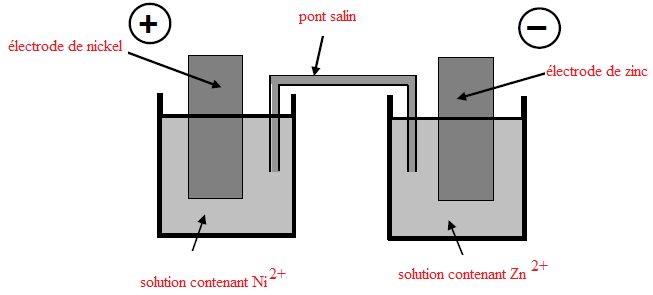
On réalise la pile formée à partir des couples Ni2+/Ni et Zn2+/Zn.
M(Zn) = 65,4 g/mol ; M(Ni) = 58,7 g/mol ; e = 1,6 10-19 C ; NA
= 6,02 1023 mol-1 ; F = 96500 C.
Pour la réaction suivante Ni2++Zn = Zn2+ + Ni, la
constante vaut K = 1018.
L'électrode positive de cette pile est l'électrode de nickel. Chaque
solution a pour volume V = 100 mL et la concentration initiale en ion
positif est [Ni2+]=[Zn2+]=C = 5,0 10-2
mol/L.
Légender
le schéma.
Ecrire
les demi-équations des réactions se produisant aux électrodes et
préciser s'il s'agit d'une oxydation ou d'une réduction.
Oxydation du zinc à l'anode négative : Zn (s) ---> Zn2+
aq +2e-.
Réduction des ions Ni2+ à la cathode positive : Ni2+
aq +2e----> Ni(s).
Ecrire l'équation de
la réaction globale qui intervient dans la pile.
Zn (s) +Ni2+
aq ---> Zn2+
aq +Ni(s).
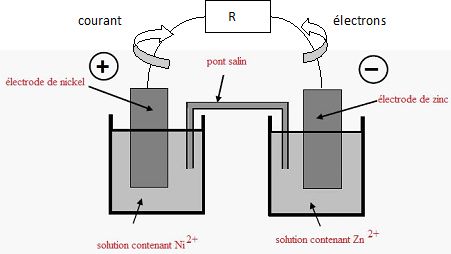
On fait
débiter la pile dans un conducteur ohmique de valeur R.
Compléter
le schéma ci-dessus. Préciser sur ce schéma le sens du courant et le
sens de déplacement des électrons dans le circuit extérieur.
Comment varie la
concentration des ions positifs dans chaque becher ?
Les ions Ni2+ disparaissent: [Ni2+] diminue. Les ions Zn2+
apparaissent: [Zn2+] croît.
|
| .
. |
|
|
Sachant que la masse
des électrodes ne limite pas la réaction, pour quelle raison la pile
s'arrêtera-t-elle de fonctionner ?
Le quotient de réaction sera égale à la constante d'équilibre K ; les
ions Ni2+ auront pratiquement disparu.
On laisse fonctionner la
pile pendant une heure. L'intensité du courant reste constante et vaut
I = 100 mA .
Calculer
la quantité d'électricité fournie par cette pile.
Q = It = 0,100 *3600 = 360 C.
En déduire la
quantité de matière d'électrons qui ont circuler.
n(e-) = Q/F = 360 /96500 =3,73 10-3 ~3,7 10-3
mol.
Quelle électrode
voit sa masse augmenter ? Calculer cette
augmentation de masse.
La masse de l'électrode de nickel augmente.
n(Ni) = ½n(e-) =1,865 10-3 mol.
m = n(Ni) M(Ni) = 1,865 10-3
*58,7 =0,109 ~0,11 g.
|
.
|
|
Concentration
et absorbance.
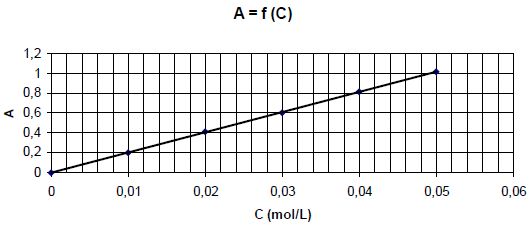
Pour des solutions de sulfate de nickel de concentrations différentes,
on trace la courbe donnant l'absorbance en fonction de la concentration
C en ion nickel Ni2+. Les mesures sont faites pour une
longueur d'onde égale à 390 nm.
Enoncer
la loi de Beer-Lambert et ses limites. Justifier le choix de la
longueur d’onde pour les
mesures.
Pour
des solution diluées, l'absorbance et la concentration de l'espèce qui
absorbe à la longueur d'onde choisie, sont propotionnelles. Afin
d'obtenir une bonne précision, on choisit la longueur d'onde
correspondant au maximum d'absorption.
Quel type d’appareil
utilise-t-on pour mesurer l’absorbance.
Un spectrophotomètre.
On
mesure l'absorbance de la solution, dans laquelle plonge l'électrode de
nickel, lorsque la pile a fonctionné une heure en débitant une
intensité de 100 mA. On rappelle que le volume de la solution est
V = 100 mL. La valeur mesurée est A = 0,65.
A
l’aide du graphe déterminer la concentration des ions Ni2+ restant en solution.
Equation de la droite : A = 20 c ; Crestante = 0,65 / 20 =
0,0325 mol/L.
Est-ce
cohérent avec le calcul de la masse de nickel déposé. Justifier votre
réponse.
Quantité
de matière en ion nickel :
initiale : CV = 0,050 *0,100 = 5,0 10-3 mol ;
au bout d'une heure : 0,0325 *0,100 = 3,25 10-3
mol ;
ayant disparu : 5,0 10-3 -3,25 10-3
=1,75 10-3 mol.
Masse de nichel déposé : 1,75 10-3 *58,7
~0,10 g. Les résultats sont cohérents.
|
|
|