Synthèses du phénol, de la synéphrine, du 2,4-DP,
concours inspecteur
CCRF 2012
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
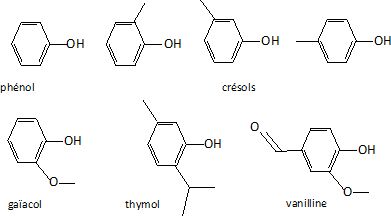
Le phénol.
Donner
les formules semi-développées ou topologiques des composés suivants
:
a) le phénol ; b) les crésols ou méthylphénols ;
c) le gaïacol ou 2-méthoxyphénol ;
d) le thymol ou 2-isopropyl-5-méthylphénols ;
e) la vanilline ou 3-méthoxy-4-hydroxybenzaldéhyde.
Quelle
différence existe t-il entre la vanille et la vanilline ?
La vanilline extraite de la gousse de vanille contient de nombreux
autres composants aromatiques, d'où la richesse de cet arôme. La
vanilline de synthèse est chimiquement pure.
Rappeler comment
était nommé le phénol au 19ème siècle. Proposer
une justification.
Acide phénique ou carbonique : substance médicamenteuse destinée à
guérir ( assèche et guérit les ulcères humides).
Expliquer
pourquoi, dans des conditions normales de température et de pression le
benzène est liquide alors que le phénol est solide.
Les molécules de phénol sont associées par des liaisons hydrogène
intermoléculaires..
Sur la classification chimique établie à ce jour pour le phénol, on
trouve les notations suivantes : "Muta. Cat. 3; R68 - T; R23/24/25 -
Xn; R48/20/21/22 - C; R34".
Indiquer
la signification des symboles Muta. Cat. 3, T, Xn, C et R.
Muta : mutagène ; cat 3 : inclassable quant à sa cancérogénécité pour
l'homme ; T : toxique ; Xn : nocif ; C : cancérogène ; R
phrase de risque.
Synthèse
industrielle du phénol.
Le principal procédé de synthèse du phénol, le procédé au cumène,
résulte de la décomposition de l'hydroperoxyde de cumyle, obtenu par
oxydation du cumène par le dioxygène (réaction 1). Cet hydro peroxyde,
traité ensuite par de l'acide sulfurique (réaction 2), à une
température inférieure à sa température d'explosibilité (170°C), se
décompose pour former du phénol et de l'acétone.
Ces deux étapes sont exothermiques. Sur le plan pratique, l'oxydation
du cumène en hydroperoxyde de cumyle peut être réalisé de plusieurs
manières. La réaction est radicalaire, autocatalytique et s'effectue à
un pH compris en 8,5 et 10,5 grâce à l'ajout de carbonate de sodium. La
réaction de décomposition en phénol est réalisée à 60°C et sous 15
bars, en présence d'une faible quantité d'acide sulfurique.
Le cumène, ou isopropylbenzène est synthétisé à partir de benzène et de
propène en présence d'acide polyphosphorique : écrire l'équation de
la réaction qui modélisera la transformation entre le benzène et le
propène. Quel est le rôle de l'acide polyphosphorique ?
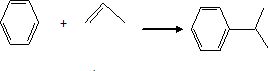
L'acide polyphosphorique joue le rôle de catalyseur.
Proposer
un mécanisme réactionnel pour cette réaction en milieu acide. Quels
qualitatifs peut-on donner aux différents réactifs en considérant leur
rôle dans le mécanisme ?
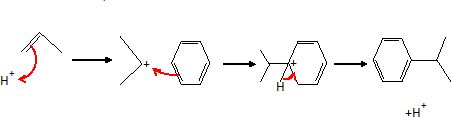
Etape 1 : formation d'un carbocation, espèce électrophile.
Etape 2 : addition du composé électrophile sur le noyau benzénique.
Etape 3 : réaromatisation du cycle benzénique.
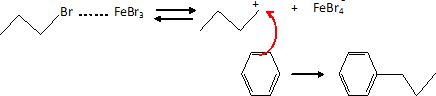
Quels
seraient les produits formés si le 1-bromopropane était utilisé en
présence de tribromure de fer III à la place du propène ? Justifier.
|
| .
. |
|
|
Ecrire l'équation de
la réaction qui modélise la transformation chimique entre le cumène et
le dioxygène.
C6H5-CH(CH3)2 + O2
--->C6H5-C(CH3)2
-O-OH.
Comment peut-on
définir une transformation autocatalytique ?
Le catalyseur est l'un des produits de la réaction.
Ecrire
l'équation de la réaction qui modélise la transformation chimique de
l'hydropéroxyde de cumyle et conduisant à la formation du phénol. Quel
est l'intérêt de cette synthèse ?
C6H5-C(CH3)2
-O-OH ---> C6H5-OH
+ CH3-CO-CH3.
On limite le coût des réactifs ( ici O2) et on valorise le
sous produit, l'acétone utilisée comme solvant.
Proposer une autre
synthèse du phénol à partir du benzène.
Fusion alcaline d'un sel d'acide sulfonique.
|
.
|
|
Synthèse de la
synéphrine.
La synéphrine est un médicament de type adrénaline utilisé dans le cas
de défaillance cardiaque, syncope ou état asthénique post opératoire.
Le phénol est dissous dans une solution d'hydroxyde de sodium
pour donner le composé A, qui réagit dans l'iodométhane pour fournir B.
Trouver
les composés A et B.
A est l'ion phénate C6H5-O-; Na+.
B est C6H5-O-CH3.
Par action
du chlorure d'éthanoyle en présence de trichlorure d'aluminium, B donne
très majoritairement C.
Trouver
C. Donner son mécanisme de formation.
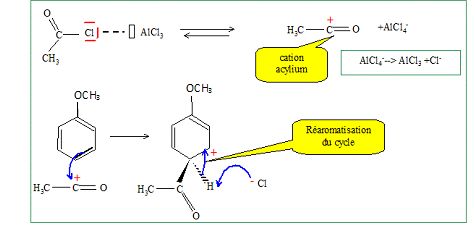
Quelle
quantité de trichlorure d'aluminium faut-il utiliser et pourquoi ?
Le catalyseur étant régénéré lors de la dernière étape, il faut peu de
trichlorure d'aluminium.
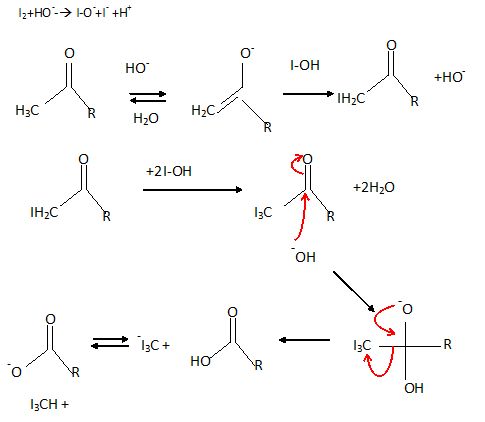
Par action du diiode en milieu basique, C conduit à la formation
de C1 et d'un solide jaune appelé iodoforme.
Identifier
C1 et donner le
mécanisme de cette étape. On note R : -C6H5-OCH3.
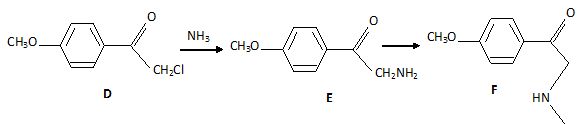
Par action du dichlore en milieu légèrement acide, C ne subit qu'une
monochloration pour conduire à D. Donner sa formule
semi-développée.
D réagit de manière équimolaire avec l'ammoniac pour fournir E,
qui réagit de manière équimolaire avec la chlorométhane pour former F.Trouver E et F.
Quel
composé obtiendrait-on par action du nitrite de sodium, en milieu acide
chlorhydrique, sur E, et sur F ?
La nitrosation d'un amine par l'acide nitreux, préparé dans le milieu
réactionnel, conduit à un sel de diazonium ( pour une amine
primaire ) et à une N-nitrosoamine pour une amine secondaire.
F, par action du tétrahydruroborate de sodium en milieu alcoolique et
aqueux, donne G, qui sous l'action de l'iodure d'hydrogène fournit la
synéphrine H. Trouver
G et H.
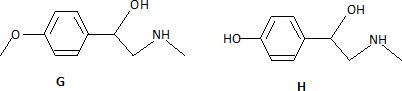
Représenter le stéréoisomère de configuration R de H, en représentation
de Cram en précisant le classement des substituants.
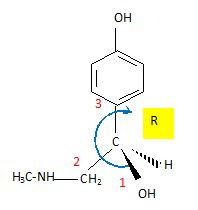
Quel a
été l'intérêt de former B ?
Protection de la fonction phénol.
|
Synthèse
du 2,4 DP.
La molécule de 2,4 DP ou acide 2-(2,4-dichlorophénoxy)propanoique est
un composé polyfonctionnel de formule :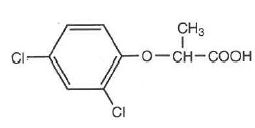
Inventorier les fonctions organiques dans la molécule.
Fonction acide carboxylique COOH ; éther de phénol ; dérivé aromatique chloré.
La 2,4 DP est-elle une molécule chirale? Justifier.
La molécule possède un atome de carbone asymétrique : elle est chirale.
En utilisant la projection de Cram, représenter les
stéréoisomères de configuration du 2,4 DP.
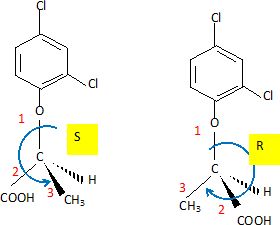
Indiquer la relation de stéréoisomèrie entre les composés
représentés. Par quelles propriétés physiques et/ou chimiques peuvent-ils être différents?
Deux énantiomères agissent différemment sur la lumière polarisée. Ils ont les mêmes propriétés chimiques.
Ecrire l'équation qui modélise la transformation chimique de
synthèse de la 2,4 DP à partir du phénol et du dichlore. Donner la structure de Lewis de AlCl3 et
préciser de quelle manière il agit.
AlCl3 est un acide de Lewis :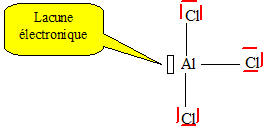
Donner le mécanisme réactionnel de la monochloration du phénol.
Dire quel est le produit majoritairement obtenu et justifier.
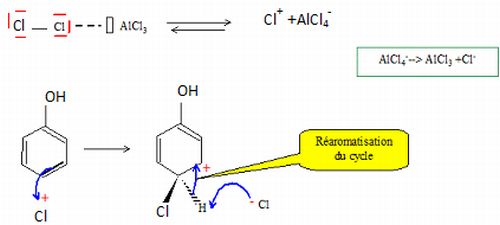
Le produit para est majoritaire ; le produit ortho est minoritaire, la position ortho est encombrée.
Cette transformation, dans les conditions usuelles, est réalisée
sous contrôle cinétique.
Expliquer la signification de ceci et préciser l'étape cinétiquement
limitante.
Les conditions de réactions conduisent au produit qui se forme le plus raoidement. L'addition de l'électrophile Cl+ sur le cycle est lente.
Expliquer pourquoi la monochloration est plus rapide sur le
phénol que le benzène.
OH est un groupe donneur : les densités électroniques sont accrues en positions ortho et para.
Citer 2 exemples d'autres groupements ayant les mêmes effets
électroniques que le groupement -OH.
Le groupe amino, les groupes alkyles et alkoxy, donneurs d'électrons, activent les positions ortho et para.
Justifier l'obtention majoritaire du 2,4 DP plutôt que du 2,6 DP.
La position ortho est encombrée par le groupe O-CHCH3-COOH
|
|
|