QCM chimie,
physique, sciences des matériaux. Concours technicien en sciences des
matériaux Lorraine 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
36)Les
unités de mesure sont parfois assorties d’un préfixe signifiant un
multiple ou un sous-multiple de l’unité correspondante. A quel multiple
ou sous-multiple, exprimé en puissance de 10, correspondent les
préfixes suivant ?
milli : 10-3 ; nano : 10-9 ; hecto : 102 ; téra : 1012 ; femto : 10-15 ; giga : 109 ; atto :10-18 ; exa 1018.
37) Quelle est la différence entre un clivage et une cassure ?
Un clivage s'effectue suivant une direction bien déterminée.
Le minéral se brise en présentant des surface de cassure irrégulières.
38) Une caméra CCD possède une profondeur dynamique de 16 bits. Que cela signifie-t-il ?
La
profondeur de bits est définie par le nombre de bits utilisés pour
représenter chaque pixel. Plus le nombre de bit est élevé, plus grans
sera le niveau de teintes.
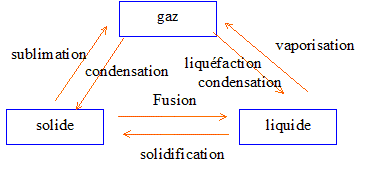
39)
Complétez le tableau ci-dessous avec les mots qui correspondent aux
changements d’état physique : Fusion ; vaporisation ; liquéfaction ;
solidification ; condensation ; sublimation.
40) Qu’appelle-t-on le waist d’un faisceau laser ?
Le waist est’endroit où la demi épaisseur du faisceau
est la plus faible et la ou les faisceaux lumineux sont parallèles.
41) Qu’est-ce qu’un système afocal ? Donner un exemple d’instrument afocal.
La vergence d'une lunette astronomique est nulle : c'est un système afocal.
42) Qu’est-ce qu’un matériau biréfringent ?
Dans un matériau
biréfringent, la lumière se propage de manière anisotrope. L'indice de
réfraction du matériau dépend de la direction de polarisation de l'onde
lumineuse.
43) Qu’est-ce que la profondeur de champ d’un microscope optique ?
La
profondeur de champ est la zone de l'espace dans laquelle doit se
trouver un objet de petites dimensions afin que son image soit nette.
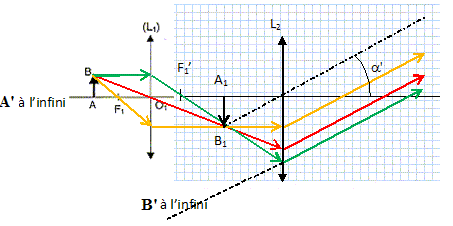
44) Indiquez un montage utilisant deux lentilles convergentes donnant une image droite et faire un schéma du trajet optique.
Le microscope :
|
| .
. |
|
|
45) Le
silicium est situé dans la classification périodique des éléments dans
la même colonne que le carbone, dans la période suivante.
Quel est le numéro atomique du silicium ? 6+8 = 14.
Quel est l’oxyde de silicium le plus répandu dans la nature ? Sous quelle forme ? Quel est son système cristallin ?
La silice SiO2 : réseau de Bravais hexagonal.
Dans les céramiques interviennent du nitrure et du carbure de
silicium. Quelles sont les formules brutes des formes stables de ces
composés ?
Si3N4 ; SiC.
46) Diagramme de phase Cu-Ni
NB : Les compositions élémentaires sont données en pourcentage massique.
On observe la fusion d’un mélange 35%Ni, 65%Cu à T0 = 1250°C. Le diagramme de phase correspondant est donné ci-dessous.
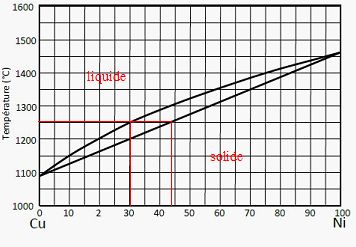
Quelle est la température de fusion du cuivre ? 1080°C.
Quelle est la composition de la phase liquide à la T0 ?
70 % de cuivre et 30% de nickel.
Quelle est la composition de la phase solide à la T0 ?
52 % de cuivre et 48 % de nickel.
Quelles sont les proportions de phase liquide et de phase solide à T0 ?
fs : proportion en masse du solide ; fl: proportion en masse de la phase liquide.
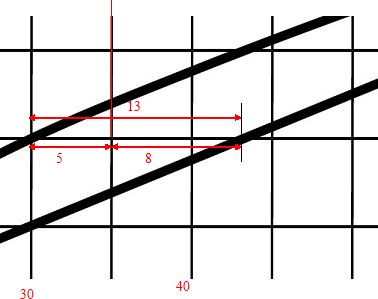
Règle des moments chimiques : fs= 5/13 ~0,38 ; fl =8/13 ~0,62.
|
.
|
|
46) La pyrite est un sulfure naturel de fer : FeS2. La pyrite réagit avec un des composant de l’air pour former de l’oxyde ferrique et du dioxyde de souffre.
Donner l’équation de la réaction.
2FeS2 + 5,5O2 ---> Fe2O3 + 4SO2.
Quelle masse de pyrite faut-il traiter pour obtenir 880g d’oxyde de fer ?
n(Fe2O3) = 880 / 160 =5,5 mol ; n(FeS2) = 2*5,5 = 11 mol ; m(FeS2) =11* 88=968 g.
Quel est le volume de dioxyde de souffre obtenu ?
n(SO2) = 4n(Fe2O3) =22 mol. V = 22 Vm = 22*22,4 =493 L.
47) Compléter le tableau ci-dessous :
KMnO4
|
ZrO2
|
AgNO3
|
C2HCl3
|
CH3OCH3
|
CH3CH2OH
|
ZrO2
|
Al2O3
|
CH3OH
|
H2SO4
|
Permanganate de potassium
|
Dioxyde de zirconium
|
Nitrate d'argent
|
Trichloroéthène
|
Diméthyléther
|
Alcool éthylique
|
Zircone
|
Alumine
|
Méthanol
|
Acide sulfurique
|
49) Citer deux éléments : Halogène : fluor, chlore ; alcalino-terreux : calcium, magnésium ; gaz rares ( nobles) : argon, néon ;
métaux de transition : fer, nickel ; alcalins : sodium, potassium ; métalloïdes : bore, silicium.
50) On considère un litre d'azote liquide (LN2) à la pression atmosphérique. µ = 806,6 g/L.
Calculer le volume de gaz correspondant produit après évaporation complète à température ambiante.
n(diazote) = 806,6 / 28 = 28,8 mol ; V = 28,8 Vm = 28,8*24 =691 L.
Quel danger y-a-t-il à stocker un récipient ouvert contenant une
grande quantité d'azote liquide dans un local non ventilé ?
Risque d'asphixie en respirant un gaz apauvri en dioxygène.
51)
Le silicium naturel est composé de trois isotopes stables : 2814Si, 2914Si et 3014Si de
masse atomiques respectives (en u.m.a.) 27,977 ; 28,977 et 29,974.
Indiquer le nombre de protons, de neutrons et d’électron pour ces trois atomes.
2814Si : 14 protons, 14 électrons, 14 neutrons ; 2914Si 14 protons, 14 électrons, 15 neutrons
et 3014Si : 14 protons, 14 électrons, 16 neutrons.
Sachant que 2814Si est 11,9 fois plus abondant que l’ensemble des deux
autres isotopes et que la masse atomique moyenne du silicium naturel
est de 28,0855 uma, calculer l’abondance de chacun des isotopes dans le
silicium naturel.
Abondance de 2914Si : x ; abondance de 3014Si : y ; abondance de 2814Si : 1-(x+y). ;
28,977x +29,974 y +27,977(1-x-y)=28,0855 soit x+1,997y=0,1085 ; x = 0,1085-1,997y.
27,977(1-x-y)= 11,9*28,977x +29,974 y soit 27,977 = 372,8033x +384,6676y.
27,977 = 372,8033*(0,1085 -1,997y) +384,6676y.
y = 0,03466 ; x = 0,03928 ; 2814Si : 0,926.
|
|
|
52) On dissout 10 g de chlorure de sodium et 10 g de dichlorure de calcium dans 250 mL d'eau.
Calculer les pourcentages en masses et en quantités de matière (en
moles) des constituants (chlorure de sodium et dichlorure de calcium)
introduits dans la solution.
Données : masses molaires (g/mol) Na=23 ; Ca=40 ; Cl=35,5 ; H=1 ; O=16.
% massiques : 50 % NaCl et 50 % CaCl2.
n(NaCl) = 10 / 58,5 =0,171 mol ; n(CaCl2) = 10 / 111=0,090 mol ; % molaire NaCl : 0,171 / (0,171+0,090) *100= 65,5 %.
% molaire CaCl2 = 100*0,090 / 0,261 = 34,5 %.
53)
On dispose de deux solutions aqueuses, l'une (solution S1) contient
1,15.10-2 mol d'acide chlorhydrique HCl, dans 2.10-1 L d'eau, l'autre
(solution S2) contient 1,15.10-2 mol d'hydroxyde de sodium NaOH, dans
1.10-1 L d'eau. Evaluer le pH des deux solutions.
C1 = 0,0115 / 0,2 =0,0575 mol/L ; pH = - log 0,0575 ~1,2.
C2 = 0,0115 / 0,1 =0,115 mol/L ; pH = 14+ log 0,115 ~13
54)
On constitue les quatre mélanges reportés dans le tableau ci-dessous.
Compléter le tableau en évaluant le pH de chacun des mélanges
Mélange
|
Volume de S1 ( mL)
|
Volume de S2( mL) |
Volume d'eau ajouté( mL) |
pH
|
1
|
10
|
0
|
10
|
1,5
|
2
|
10
|
2
|
8
|
1,8
|
3
|
10
|
5
|
5
|
7
|
4
|
10
|
10
|
0
|
12,5
|
Mélange 1 : dilution de S1 de facteur 2 : C'1 = 0,0575 / 2 =0,0287 mol/L ; pH ~1,5.
Réaction acide base H+aq+HO-aq ---> H2O pour les trois autres mélanges.
Mélange 2 : 10C1 = 10*0,0575 =0,575 mmol ; 2C2 = 2*0,115 =0,23 mmol ; l'acide est en excès de 0,345 mmol dans 20 mL de solution.
pH =-log(0,345 / 20)= 1,76 ~1,8.
Mélange 3 : 10C1 = 10*0,0575 =0,575 mmol ; 5C2 = 5*0,115 =0,575 mmol ; proportions stoechiométriques, dosage acide fort base forte pH = 7.
Mélange 4 : 10C1 = 10*0,0575 =0,575 mmol ; 10C2 = 10*0,115 =1,15 mmol ; la soude est en excès de 0,575 mmol dans 20 mL de solution.
pH =14+log(0,575 / 20)= 12,46 ~12,5.
55) Equilibrer l'équation d'oxydo-réduction suivante.
MnO4- + 8H3O+ + 5Fe2+---> Mn2+ + 12H2O +5 Fe3+.
|
|
|



