QCM ; nickelage
chimique, acide hypophosphoreux. Concours technicien en sciences des
matériaux Montpellier 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
QCM
1. Les UV sont :
a) Dans une plage de longueur d’onde supérieure à celle du visible et
l’énergie d’un photon est
inférieure à celle d’un photon du visible.
b) Dans une plage de longueur d’onde supérieure à celle du visible et
l’énergie d’un photon est
supérieure à celle d’un photon du visible.
c) Dans une plage de longueur d’onde inférieure à celle du visible et
l’énergie d’un photon est
inférieure à celle d’un photon du visible.
d) Dans une plage
de longueur d’onde inférieure à celle du visible et l’énergie d’un
photon est
supérieure à celle d’un photon du visible. Vrai. E = hc / l.
2)
Deux atomes sont dits isotopes s’ils ont :
a) Le même nombre d’électrons et un nombre différent de neutrons
b) Le même nombre
de protons et un nombre différent de neutrons. Vrai.
c) Le même nombre
d’électrons et le même nombre de neutrons
d) Le même nombre de protons et le même nombre de neutrons.
3) Un récipient sous atmosphère
ambiante est rempli au tiers de sa capacité avec de l’eau,
puis il est fermé hermétiquement. On chauffe :
a) L’eau va bouillir au-dessous de 100 °C.
b) L’eau va bouillir à 100 °C.
c) L’eau va
bouillir au dessus de 100 °C. Vrai.
Ce récipient correspond à
une cocotte-minute avant que la soupape ne s'ouvre.
d) L’eau ne pourra jamais bouillir.
4) On veut
réaliser une pile cuivre-zinc en utilisant des plaques de cuivre et de
zinc et des
solutions de sulfate de cuivre et de zinc de concentrations 0,1 mol.L-1.
Sachant que le
potentiel standard des couples red/ox sont les suivants : E° (Cu2+/Cu)
= 0,34 V et E° (Zn2+/Zn) = -0,76 V, indiquez quelle sera la
cathode :
a) Le cuivre. Vrai.
b) Le zinc
c) Les données ne permettent pas de le dire.
Le métal le plus
réducteur, le zinc s'oxyde : c'est l'anode négative.
5) Quel est le
degré d’oxydation de l’uranium dans le cation uranyle, de formule UO22+
:
a) +2 ; b) +4 ; c) +6 ; vrai
d) +8.
x + 2(-2) = 2 ; x = 6.
6) Sachant que le chlore possède 7
électrons sur sa couche externe, combien de doublets
liants et non liants forme-t-il dans une molécule de dichlore ?
a) 1 non liant et 3 liants
b) 2 non liants et 2 liants
c) 3 non liants et
1 liant. vrai.
7) Un mélange eutectique est :
a) Un mélange homogène de deux corps purs
b) Une solution solide
c) Un mélange de
deux corps purs qui fond et se solidifie à température constante. Vrai
d) Un mélange liquide qui bout à température fixe en
gardant une composition fixe.
8) La configuration électronique du
silicium (numéro atomique 14) est :
a) 1s2 2s2 2p4 3s2 3p6
b) 1s2 2s2 2p6 3s2
3p2. Vrai
c) 1s2
2s2 2p4 3s2 3p23d2.
9) Un polyester peut être synthétisé
à partir de :
a) Un acide carboxylique et un alcool
b) Un acide carboxylique et un diol
c) Un diacide carboxylique et un alcool
d) Un diacide carboxylique et une diamine.
Synthèse à partir d''un
diacide carboxylique ou d'un de ces dérivés et d'un diol : polycondensation par estérification.
|
| .
. |
|
|
10) On se propose de réaliser un
titrage pH-métrique d’une solution S d’acide sulfurique de
concentration 0,06 mol.L-1 en utilisant une solution de
soude de concentration 0,1 mol.L-1. A
partir d’une prise d’essai 10 mL de la solution S, le volume de soude
versé à l’équivalence
sera : a) 3 mL ; b) 6 mL ; c)
12 mL vrai ; d) 60 mL.
Titrage d'un diacide fort
par une monobase forte : H3O+ 2HO-
= 2H2O.
A l'équivalence cava
= cbvb avec ca
= 2*0,06 = 0,12 mol/L ; vb =0,12*10 / 0,1 = 12 mL.
11) Quel terme ne désigne pas un système cristallin ?
a) Rhomboédrique
b) Triclinique
c) Quadratique
d) Graphitique. Vrai.
12) Comment conserve-t-on du sodium solide au laboratoire ?
a) Dans du pétrole.Vrai.
b) A sec, dans un récipient à l’abri de la lumière.
c) Dans de l’eau, dans un récipient fermé.
d) Dans un récipient fermé, sous atmosphère d’hydrogène.
13) La valeur du
nombre d’Avogadro est égale à :
a) 6.02 10-23 mol ; b)
6.02 1023 mol-1 vrai ; c) 6.02 1023 mol ; d) 6.02 10-23
mol-1.
14) Le module
d’élasticité d’un matériau se détermine :
a) A partir des
courbes de contrainte en fonction de la déformation relative. Vrai
b) A partir des courbes de déformation relative
en fonction de la température
c) A partir des courbes de déformation relative en fonction du temps.
16) La dérivée de
la fonction f(t) = 4sin(wt)
est :
a) f’(t) = 4w cos(w)
b) f’(t) = –4w cos(wt)
c) f’(t) = 4w cos(wt). Vrai
d) f’(t) = 4wt cos(wt).
15) Le principe de
la spectroscopie Infra-Rouge repose sur :
a) Les transitions de phases
b) Les transitions
vibrationnelles.Vrai
c) Les transitions électroniques
d) Les transitions thermiques.
|
.
|
|
Protection
contre la corrosion par dépôt de nickel.
Une plaque d’acier peut être protégée de la corrosion en la recouvrant
par une fine couche de nickel métallique Ni(s). Le dépôt peut être
réalisé par électrolyse ou par réaction chimique. On s’intéresse dans
cet exercice au procédé chimique (partie A) et au procédé
électrochimique (partie B).
A- Nickelage
chimique.
Le dépôt du nickel se fait par réduction des ions nickel(II) (Ni2+
(aq)) par les ions hypophosphite H2PO2-(aq),ceux-ci
étant oxydés en ions dihydrogénophosphate H2PO4-(aq).
Les deux faces et lesquatre bords de la plaque ont une surface totale S
égale à 425 cm2. On souhaite réaliser un dépôt d’épaisseur
e(Ni) = 0,100 mm.
Le nickelage est réalisé à 25°C en plongeant, le temps nécessaire, la
plaque d’acier dans un volume V= 3,00 L d’une solution de chlorure de
nickel (II) et d’hypophosphite de sodium. On notera C la concentration
en ions nickel Ni2+ et C’ la concentration en ion
hypophosphite H2PO2-(aq).
Déterminer la quantité de matière (exprimée en mol) de nickel à déposer.
Volume de nickel : V = S
e(Ni) = 425 *0,010 = 4,25 cm3. Masse de nickel m = V µ(Ni) = 4,25
*8,92 = 37,91 g.
Quantité de matière de
nickel : n = m / M(Ni) = 37,91 / 58,7 = 0,6458 ~0,646 mol.
Ecrire la réaction d’oxydo-réduction conduisant au dépôt de nickel. On
précisera quel est l’oxydant et quel est le réducteur.
Réduction de l'ion Ni2+,
l'oxydant : 2Ni2+ aq+ 4e-
=2 Ni(s).
Oxydation de H2PO2-(aq),
le réducteur : H2PO2-(aq)+2H2O
=H2PO4-(aq)
+ 4e-+ 4H+aq.
H2PO2-(aq)+2H2O
+2Ni2+ aq =H2PO4-(aq)
+ 2 Ni(s)+ 4H+aq.
Etablir la relation entre la quantité de
matière exprimée en mol de nickel à déposer et celle des ions Ni2+
dans la solution. On supposera que la réaction d’oxydo-réduction est
totale.
n(Ni) = n(Ni2+).
Déterminer la valeur de
la concentration C.
C=n(Ni2+) / V= 0,6458 / 3,00
=0,2153 ~0,215 mol/L.
Etablir la relation liant
la quantité de matière (exprimée en mol) des réactifs Ni2+
et H2PO2- supposés en proportions stoechiométriques.
n(Ni2+) = 2n(H2PO2-).
En déduire la
valeur de C’.
C' = n(H2PO2-) / V = 0,5*0,6458 / 3,00
=0,1076 ~0,108 mol/L.
Nickelage
électrochimique.
On dispose d’un électrolyseur (ou cuve à électrolyse), d’un générateur
de courant continu, d’une électrode nickel et d’une solution de
chlorure de Nickel (II).
Proposer un montage permettant de réaliser le dépôt de nickel par
électrolyse. On supposera que seules les espèces Ni2+ et Ni
sont impliquées dans les réactions électrochimiques. On précisera le
branchement des électrodes aux bornes + et – du générateur.
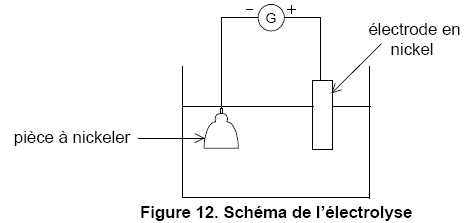
Quelle est la valeur de l’intensité
permettant un dépôt de 0,6 g par heure ?
n(Ni) = m / M(Ni) =0,6 /
58,7 = 0,01022 mol / heure.
n(e-
) = 2 n(Ni) = 0,02044 mol / heure.
Q = It = n(e- )F ; I = n(e-
) / t F =0,02044 /3600* 96500 = 0,548 A.
Calculer la durée exprimée en heures et
minutes permettant un dépôt de 0,100 mm sur la plaque de surface 425 cm2.
n(Ni) = 0,6458 mol.
n(e- ) = 2 n(Ni) = 1,2916 mol.
Q = It = n(e- )F ; t= n(e-
) / I F =1,2916 /0,548* 96500 =2,27 105 s = 63 h 11 min.
|
|
|
Préparation et
contrôle d’une solution d’acide hypophosphoreux (H3PO2)
L’acide hypophosphoreux H3PO2 est une acide de
Bronsted dont le pKa est égal à 1,2. Sa masse molaire est
égale à 66 g.mol-1.
Que signifie le terme acide de Brönsted ?
Un acide de Brönsted(
possédant une lacune électronique ) est un accepteur de doublet
électronique.
Indiquer les équilibres mis en jeu lorsqu’on dissout cet acide
dans l’eau.
H3PO2 aq +H2O = H2PO2-
aq +H3O+aq et H3O+aq
+HO-aq = 2H2O.
Quelle est, à pH= 3, la
forme prépondérante de cet acide ? Justifier votre réponse.
A pH supérieur à pKa,
la forme base conjuguée H2PO2-
aq prédomine.
On trouve
dans le commerce une solution aqueuse à 50 % en masse ? Sachant que la
masse volumique de cette solution est de 1,27 g.mL-1 quel
volume de solution faut-il prélever pour
préparer un litre d’une solution d’acide hypophosphoreux de
concentration en soluté apporté C =0,5 mol.L-1 ?
Masse d'acide
hypophosphoreux dans un litre de solution commerciale : 1270 *0,5 = 635 g.
Concentration de cet acide : 635 / 66 ~9,62 mol/L.
Facteur de dilution : 9,62 / 0,5 = 19,24 ; volume à prélever :
1000 / 19,24 ~52 mL.
On dose la
solution ainsi obtenue par une solution de soude de concentration 0,200
mol.L-1. Ecrire la réaction de dosage.
H3PO2 aq + HO-aq
= H2PO2-
aq +H2O.
Pour réaliser ce dosage,
on a versé dans un bécher 5 mL de la solution d’acide, 100 mL d’eau
distillée et quelques gouttes d’un indicateur coloré. L’équivalence est
observée lorsque
15,4 mL de soude ont été versés. Evaluer la concentration de l’acide
qui a été préparé.
A l'équivalence cava
= cbvb ; ca
= cbvb
/ va = 0,200 *15,4
/ 5 =0,616 ~0,62 mol/L.
Suggérer une autre méthode de
détermination du point équivalent.
Suivi pHmétrique et
méthode des tangentes.
|
|
|
