QCM
: avancement, spectrophotométrie, réaction acido-basique, polarité,
solvant.
Concours kiné St Michel 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
8. Evolution d'un système chimique.
( 1 pt).
On considère la réaction de combustion de l'éthane dans le dioxygène
dont les produits sont l'eau et le dioxyde de carbone.
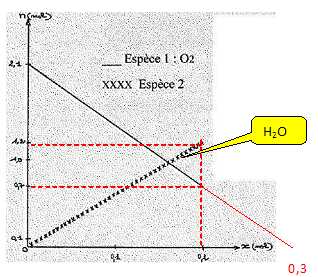
- La combustion de
l'éthane est complète.
Vrai.
|
avancement
(mol) |
2C2H6 |
+7O2 |
---> 4CO2 |
+ 6H2O |
| initial |
0 |
n |
2,1 |
0 |
0 |
| en cours |
x=0,1 |
n-2x |
2,1-7x |
4x = 0,4 |
6x |
| fin |
xf=0,2 |
n-2xf |
2,1-7 xf=0,7 |
4xf
=0,8 |
6xf
=1,2 |
|
xmax
=0,3 |
n-2xmax |
2,1-7xmax |
4xmax |
6xmax |
Finalement il reste 0,7 mol de
dioxygène.
-
Pour un avancement x= 0,1 mol, il s'est formé 0,4 mol de dioxyde de
carbone. Vrai.
-
Pour une quantité de matière initiale d'éthane de 0,6 mol, la réaction
se produit dans des proportions stoechiométriques.
Vrai.
-
Il
n'est pas possible d'identifier l'espèce 2.
Faux.
9. Représentation et géométrie des
molécules.
(0,5 pt)
On considère les molécules de formules brute CS2
et PHCl2.
- Ces molécules ne
sont pas des molécules organiques.
Vrai.
-
La molécule CS2 est une molécule coudée comme H2O.
Faux.
CS2,
comme CO2 est linéaire.
-
La molécule PHCl2 présente une géométie
pyramidale.
Vrai.
Comme NHCl2.
- est
la représentation de Lewis de PHCl2.
Faux.
Il
manque un doublet sur le phosphore.
Suivi par
spectrophotométrie.
Afin de déterminer la concentration en peroxyde d'hydrogène, notée CCom,
contenue dans une solution commerciale, on étudie la réaction entre les
ions iodure I- et le peroxyde d'hydrogène H2O2
en milieu acide. Cette réaction est lente et totale.
Avant de faire réagir la solution commerciale d'eau oxygénée, on la
dilue d'un facteur 10 afin d'obtenir une solution de volume V = 50 mL.
Le spectrophotomètre mesure une absorbance A0
=0,60 pour une solution aqueuse de diiode de concentration c0
=0,010 mol/L.
A une date t=0, on mélange dans un becher une solution d'iodure de
potassium de volume V' = 25 mL de concentration c' =0,050
mol/L et acidifiée à la solution préparée d'eau oxygénée de volume V =
50 mL et de concentration inconnue c. L'eau oxygénée sera considérée
come le réactif limitant.
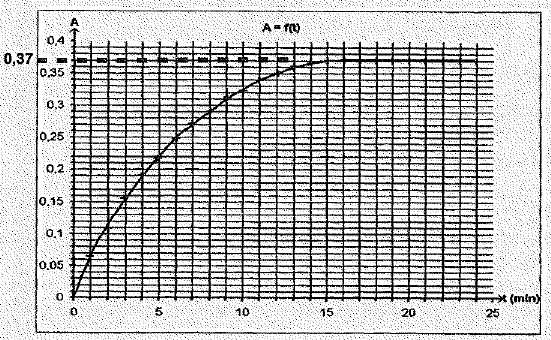
On verse rapidement un faible volume de ce mélange réactionnel dans une
cuve qu'on introduit dans le spectrophotomètre. La courbe suivante
donne l'absorbance au cours du temps.
Couples mis en jeu : I 2aq / I -aq
; H 2O 2aq / H 2O(l).
|
| .
. |
|
|
10.
(1 pt)
- La réaction a pour équation : H2O2aq
+2I-aq +2H+aq---> I2aq
+ 2H2O(l).
Vrai.
- Pour préparer
la solution diluée d'eau oxygénée, il faut prélever 5,0 mL de la
solution commerciale.
Vrai.
- Le coefficient de
proportionalité de la loi de Beer-Lambert est k = 60 L mol-1.
Vrai.
A0 = k c0
; k = 0,60 / 0,010 = 60 L mol-1.
- La solution devient de moins en
moins jaune au cours du temps. Faux.
La
concentration du diiode croît.
11.
(1 pt ).
- On peut
considérer que la réaction est terminée au bout de 15 minutes.
Vrai.
La courbe A
= f(t) atteint un palier et l'eau oxygénée est en défaut.
- L'avancement maximal est xmax = 4,5 10-4
mol.
Vrai.
xmax = [I2aq] fois volume total =Amax / k *(V'+V)=0,37 / 60 *(50+25)
10-3= 4,6 10-4 mol.
- La solution commerciale a pour concentration CCom
= 10Amax(V'+V) / (kV).
Vrai.
CCom
=10 xmax /V = 10 Amax(V'+V) / (kV).
- Cette réaction a toutes les caractéristiques d'une réaction de
titrage. Faux.
Une réaction
de titrage doit être rapide
et totale.
|
.
|
|
12. Réaction acidobasique. 1 pt.
L'hydroxylamine NH2OH est une espèce chimique dérivée de l'ammoniac. La réaction de l'hydroxylamine avec l'eau conduit à un état d'équilibre.
Ka(NH3OH+aq / NH2OH aq) =10-6,1.
- L'équation de la réaction de l'hydroxylamine avec l'eau est :
NH2OH aq + H2O(l) =NH3OH+aq +HO-aq. Vrai.
- Dans une solution de pH = 6,1, les concentrations des espèces NH3OH+aq et NH2OH aq sont égales. Vrai.
- L'hydroxylamine est un acide faible. Faux.
L'hydroxylamine est une base faible.
- Lorsque pH = 8,1, on a : [NH3OH+aq] / [NH2OH aq]=0,01. Vrai.
pH = pKa + log ( [NH2OH aq] /[NH3OH+aq]) ; log( [NH2OH aq] /[NH3OH+aq]) =pH-pKa =8,1-6,1 =2 ;
[NH2OH aq] /[NH3OH+aq] = 100 ; [NH3OH+aq] / [NH2OH aq]=0,01.
13. Polarité, solvant (0,5 pt).
- Le tétrachlorméthane CCl4 est un solvant polaire. Faux.
Du fait de sa symétrie, la molécule CCl4 est apolaire.
- Le méthanol est soluble dans l'ammoniac. Vrai.
Ce sont deux molécules polaires.
- Une molécule qui présente des atomes dont l'électronégativité est différente est forcément polaire. Faux.
Il faut en plus tenir compte des symétries.
- L'ammoniac est un solvant dont la cohésion est essentiellement assurée par des interactions de van der Waals. Faux..
14. Isoméries.
0,5 pt.
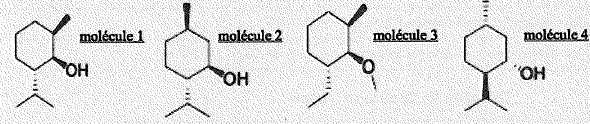
- Ces molécules sont isomères et comportent toutes 2 carbones asymétriques. Faux.
Il y a trois atomes de carbones asymétriques.
- Les molécules 2 et 4 sont images l'une de l'autre dans un miroir plan. Vrai.
- Les molécules 1 et 3 forment un couple de diastéréoisomères. Faux.
- On passe de la molécule 1 à la molécule 4 par une réaction de substitution. Faux.
3
Cu2+aq + 2Al(s)--->3Cu(s) + 2Al3+aq.
|
|
|