QCM :
spectrophotométrie, conductimétrie.
Concours kiné Rennes 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
Pour déterminer la concentration d'une
solution aqueuse S de chlorure de nickel, on prépare 50 mL d'une
solution étalon S0 à 0,30 mol/L à partir de chlorure de
nickel hexahydraté NiCl2, 6H2O. A l'aide d'un
spectrophotomètre on obtient le spectre ci-dessous.
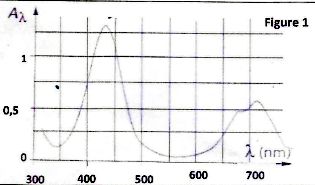
On établit ensuite les graphes donnant l'absorbance pour les deux
longueurs d'onde correspondant aux deux pics d'absorbance.
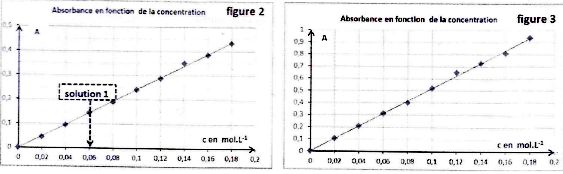
On mesure ensuite l'absorbance pour la solution S dans les deux cas (
elle est diluée 2 fois quand on opère dans le cas de la figure 3 ). On
mesure dans le cas de la figure 2, A = 0,36.
A- Pour préparer la
solution étalon S0, il faut dissoudre 3,4 g de solide dans
50 mL d'eau. ( faux ).
M(NiCl2,6H2O)
= 58,7 + 2*35,5 + 6*18 =237,7 g/mol ;
0,30 *0,05 = 0,015 mol ;
m = 237,7*0,015 3,56 ~3,6 g.
B. L'ion nichel a
pour formule Ni2+. ( vrai
).
C- La longueur
d'onde la plus absorbée correspond à du rouge. ( faux ).
lmax
~430 nm correspond au bleu.
D- Le spectre de la
figure 1 est compatible avec une couleur verte pour la solution. (
faux).
La solution possède la
couleur complémentaire du bleu soit le rouge orangé.
E- Les 4
affirmations précédentes sont fausses. ( faux ).
A-
La figure 3 a été obtenue à la longueur d'onde de 715 nm. ( faux ).
Figure 3 : l'absorbance
estt pratiquement le double de celle de la figure 2; figure 3 :
la solution a été diluée 2 fois : la longueur d'onde correspond
donc au premier maximum d'absorption.
B. Les mesures des
figures 2 et 3 avec le même matériel ( cuve et spectro ) que pour
celles de la figure 1. ( vrai
).
C- Pour réaliser la
solution 1 ( figure 2) à partir de S0, il faut une fiole
jaugée de 50 mL et une éprouvette graduée de 10 mL. ( faux ).
Une
fiole jaugée de 50 mL et une pipette jaugée de 10 mL ( facteur de
dilution 0,30 / 0,06 = 5.
D- On a dilué deux
fois la solution S ( cas de la figure 3) pour être sûr que la
proportionnalité entre A et c reste vraie. ( faux).
L'absorbance ne doit pas
dépasser l'unité. Pour une absorbance égale à 2, l'intensité de la
lumière transmise est 100 fois plus faible que celle de la lumière
incidente ; les mesures sont alors trop imprécises.
E- Les 4
affirmations précédentes sont fausses. ( faux ).
A-
D'après la figure 2 la concentration de la solution S est proche de
0,15 mol/L. ( vrai ).
A = 2,5 c ; c = A/2,5 =
0,36 / 2,5 = 0,144 ~0,15 mol/L.
B. L'absorbance
mesurée figure 3 est approximativement A = 0,77. ( faux ).
La solution S est diluée
deux fois ; c =0,075 mol/L ; la figure 3 donne A ~0,36.
C- On peut dire que
la solution inconnue contient 1,8 g de chlorure de nickel hexahydraté
pour 50 mL. ( vrai ).
La solution étalon à 0,30 mol/L a été
préparée en dissolvant 3,6 g de solide dans 50 mL d'eau distillée.
D- Si l'épaisseur
de liquide traversée par le rayon lumineux ( figure 1) est l = 8,0 10-2
m le coefficient d'absorption molaire est emax = A /(lc)
=5,4 L mol-1 cm-1. ( faux).
Amax/(lc) ~
1,3 / (8,0 *0,30 =0,54 L mol-1
cm-1.
E- Les 4
affirmations précédentes sont fausses. ( faux ).
|
| .
. |
|
|
On dose par conductimétrie une solution d'acide 2-hydroxybutanoïque par
une solution de potasse. Le graphique ci-dessous donne en fonction du
volume de base versé, la concentration en acide c(ac) et celle de la
base conjuguée c(b). Il donne aussi la conductivité de la solution.
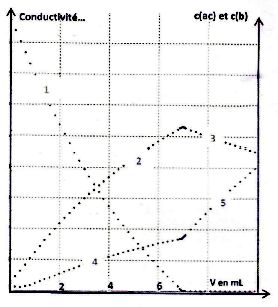
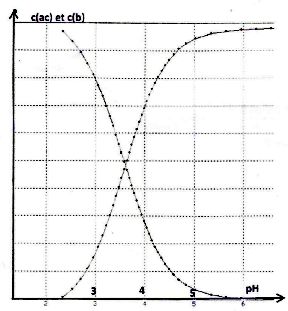
Le
graphe suivant donne les concentration c(ac) et c(b) en fonction du pH.
Le volume de la solution acide dosé est de 10 mL et la concentration de
la solution de potasse est de 0,2 mol/L.
|
.
|
|
A- La formule semi-développée de l'acide est CH3-CHOH-CH2-COOH. ( faux ).
CH3-CH2-CHOH-COOH
B. Sa formule brute est C4H7O3. ( faux ).
C4H8O3.
C- La deuxième fonction chimique présente est la fonction aldehyde. ( faux ) .
alcool secondaire.
D- La base conjuguée de cet acide est CH3-CHO--CH2-COOH. ( faux).
CH3-CH2-CHOH-COO-.
E- Les 4
affirmations précédentes sont fausses. ( vrai ).
A- La molécule de cet acide est chirale. ( vrai ).
Le carbone n°2 est asymétique.
B. Sa formule semi-développée correspond à deux isomères Z et E. ( faux ).
La présence d'un atome de carbone asymétrique conduit à deux énantiomères.
C- Dans le premier graphe ci-dessus, la courbe 1 correspond à c(b). ( faux ) .
La courbe 1 décroît jusqu'à s'annuler, il s'agit de c(ac).
D- La concentration de la forme acide est quasi nulle si le pH est supérieur au pKa. ( faux).
La concentration de la forme acide est quasi-nulle si le pH est supérieur à pKa+1.
E- Les 4
affirmations précédentes sont fausses. ( faux ).
A- Les courbes 4 et 5 correspondent à la conductivité de la solution pendant le dosage. ( vrai ).
Après l'équivalence, on ajoute des ions potassium et hydroxyde, la conductivité ne peut que croître.
B. La concentration de la solution acide de départ est de 0,14 mol/L. ( vrai ).
VE = 7 mL ; C(acide ) = 7*0,2 / 10 =0,14 mol/L.
C- La courbe 3 est déroissante car le pH augmente. ( faux ) .
Le volume de la solution augmente après l'équivalence alors que la quantité de matière de base conjuguée est constante.
D- Le pKa de l'acide est compris entre 3,5 et 4. ( vrai).
Second graphique : le pH correspondant à l'intersection des deux courbes donne le pKa.
E- Les 4
affirmations précédentes sont fausses. ( faux ).
|
|
|