Physique
chimie.
Concours Aspts Lille 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. Répondre vrai ou
faux.
Si on compare un dm3 de fer et un dm3 de plomb, on constate que le fer est le plus lourd. Faux.
La réaction du fer et du dioxygène est isothermique. Faux. ( exothermique).
Le cuivre est de couleur verte. Faux. ( rouge).
Il existe des alliages de métaux et de plastiques. Faux.
L'électron est plus lourd que le proton. Faux.
L'acide chlorhydrique est un gaz. Faux.( liquide).
Période et fréquence sont synonymes. Faux. ( la fréquence est l'inverse de la période).
Si
l'on fait tourner un aimant dans une bobine,une tension constante
apparaît aux bornes de la bobine. Faux.( La tension qui apparaît est
variable).
La soude permet d'identifier les ions cuivre ou fer. Vrai.
L'énergie cinétique d'un objet en mouvement dépend de sa vitesse. Vrai.
2. L'atome de carbone possède 6 protons. Il possède donc :
6 électrons ( vrai) ; 12 électrons ( faux) ; aucun électron ( faux).
3. Pour que des ions négatifs soient attirés vers une électrode, il faut qu'elle soit :
non chargée ( faux) ; négative ( faux) ; positive ( vrai).
4.
L'ion chlorure peut être caractérisé par :
le sulfate de cuivre ( faux) ; le sulfate de potassium ( faux) ; le nitrate d'argent (vrai) ; l'eau (faux).
5. Ce qu'on appelle la dynamo d'un vélo est en réalité :.
un modulateur ( faux) ; un alternateur ( vrai) ; un transformateur ( faux).
6. Parmi les valeurs suivantes,la tension maximale qui correspond à une tension efficace de 50 V est : 50 x1,414 = 70,7 V.
35,4 V ; 500 V ; 70,7 V ( vrai) ; 5 V.
7. L'intensité dans un récepteur de puissance 40 W alimenté sous 24 V est :
I = P / U = 40 / 24 = 1,67 A.
960 A ; 1,67 A (vrai) ; 0,6 A ; 16 A.
|
| .
. |
|
|
8. On s'intéresse aux réactifs et aux produits de la réaction fer-acide chlorhydrique.
Quels sont les ions présents dans l'acide chlorhydrique ? Donner leur nom.
Cl-, chlorure et H3O+, oxonium.
Ecrire en toutes lettres l'équation bilan de la réaction.
acide chlorhydrique + fer --> chlorure de fer (II) + dihydrogène.
2 HCl + Fe --> FeCl2 +H2.
Expliquer pourquoi le pH de la solution augmente après la transformation.
Les ions oxonium sont en partie consommés et pH = - log [H3O+].
9. Calculer la fréquence ( en kHz) d'une tension dont la période est de 0,2 ms.
T = 0,2 ms = 0,2 / 1000 = 2 10-4 s ; f = 1/T = 1/ (2 10-4) = 5000 Hz = 5 kHz.
|
|
|
|
10. Une voiture de1,2 tonnes se déplace à une vitesse constante de 100 km / h.
Calculer la distance parcourue ( en mètre ) par cette voiture pendant 5 minutes.
Distance (m) = vitesse (m/s) fois durée ( s).
d = v t avec v = 100 / 3,6 =27,78 m/s.
d = 27,78*5*60 = 8333 m ~8,3 km.
Calculer l'énergie cinétique de la voiture.
Ec=½m v2 avec m = 1200 kg.
0,5 *1200 *27,782 = 4,63 105 J.
Quelle est la vitesse ( en km / h) d'un camion de 10 tonnes qui possède la même énergie cinétique.
v2 = 2 Ec / m = 2*4,63 105 / 10 000 =92,6 ; v =9,62 m/s.
9,62 * 3,6= 34,6 km/h.
11.
La synthèse de l'acétate de linalyle s'effectue sous hotte, et le port
de gants er de lunette est obligatoire. Sans chauffage, cette réaction
'estérification aurait nécessité plusieurs jours. Indiquer par deux
flèches l'entrée et la sortie de l'eau et compléter les légendes.
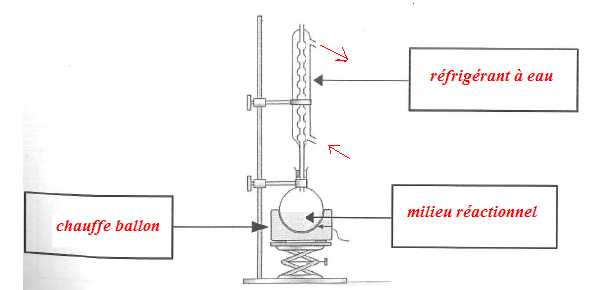
Indiquer le rôle du chauffage.
Le
chauffage à reflux accélère la réaction tout en évitant les pertes de
matière ; les vapeurs se condensent dans le réfrigérant et retombent
dans le ballon.
Indiquer le rôle des pierres ponce.
Les pierres ponce régularisent l'ébullition.
Pourquoi le réfrigérant doit-il rester ouvert à la partie supérieure ?
Cela permet d'ajouter de l'eau en fin de synthèse. On évite la surpression due aux vapeurs.
Le
contenu de l'éprouvette à la fin de la synthèse est un mélange
hétérogène. Citer les trois espèces chimiques qu'elle contient.
Acétate de linalyle, eau et acide éthanoïque.
Ecrivez en toutes lettres l'équation bilan de synthèse.
linalol + anhydride acétique --> acétate de linalyle + acide acétique.
|
|
|
|