Le
formaldehyde, un polluant domestique,
bac S Asie 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Le formaldéhyde (de formule brute
CH2O) est aujourd’hui considéré par les autorités sanitaires françaises comme un polluant prioritaire à gérer du fait de
son caractère
cancérigène certain et de la fréquence de sa présence dans notre
environnement :
panneaux de particules agglomérées, moquette, papiers peints …
En général, le formaldéhyde, émis par les matériaux de notre
environnement, est sous forme gazeuse et cette émission tend à diminuer avec le temps.
1. À propos du formaldéhyde.
1.1. Écrire la formule développée du formaldéhyde et donner son nom dans la nomenclature systématique.
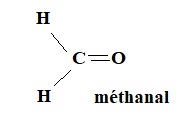
1.2. On réalise
l’analyse d’un échantillon de matériau utilisé pour fabriquer un
meuble. On obtient entre autres le spectre IR ci-dessous. Ce spectre
permet-il de soupçonner la
présence de formaldéhyde ? Justifier votre réponse.
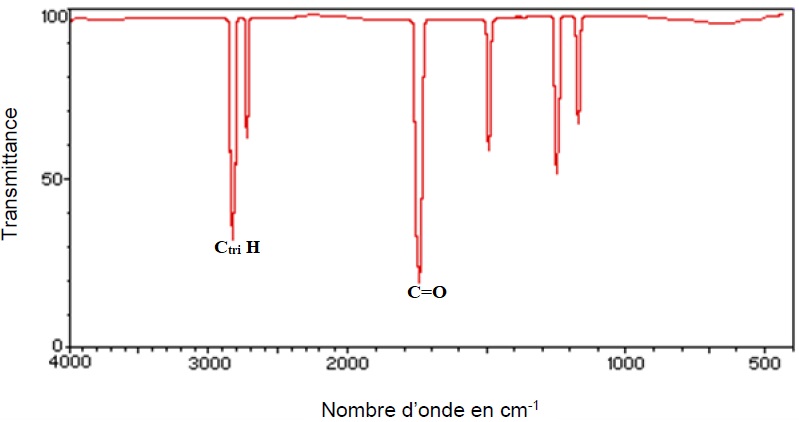
La présence de deux bandes caractéristiques des aldehydes laisse supposer la présence de formaldehyde.
2. Dosage du formaldéhyde dans un solide par spectrophotométrie.
Les solutions aqueuses de formaldéhyde sont incolores. Pour doser le
formaldéhyde par spectrophotométrie visible, on le fait au préalable
réagir avec l'acide chromotropique en
présence d'acide sulfurique. L'équation de la réaction est fournie
ci-dessous. On obtient le composé B dont l'absorption de la lumière est
maximale à la longueur d'onde 580 nm.
L'acide chromotropique (C10H8O8S2) se présente sous forme de poudre blanche ou brun clair, soluble dans l'eau.
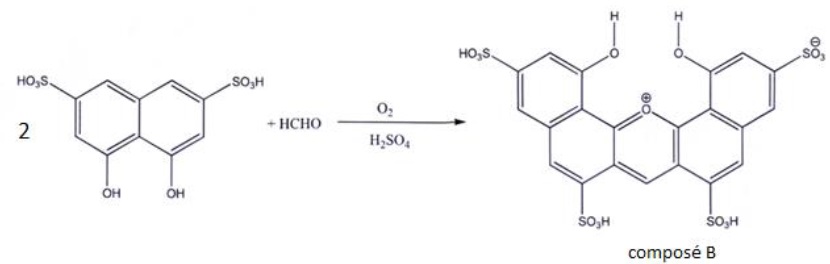
Le protocole du titrage du formaldéhyde présent dans le matériau analysé est le suivant.
Première étape : extraction du formaldéhyde dans le solide
- Un échantillon de 30,0 g de matériau est broyé puis mélangé à 300 mL d’eau.
- On laisse macérer le mélange durant 16 h puis on le filtre : le filtrat est conservé pour le dosage spectrophotométrique.
Deuxième étape : réalisation des solutions étalons
- On fabrique par dilution d’une solution mère cinq solutions étalons de concentration massique Cm en formaldéhyde de
0,1 mg/L ; 0,5 mg/L ; 2,0 mg/L ; 3,0 mg/L et 5,0 mg/L
|
|
|
Troisième étape : dosage spectrophotométrique
- Dans un bécher on place à l’aide d’une pipette 3,0 mL d’une solution étalon.
- On ajoute 0,3 mL de solution d’acide chromotropique puis 6,0 mL d’acide sulfurique concentré.
- On homogénéise et on place le mélange à l’étuve à 105°C durant 30 min : il se forme alors le composé coloré B.
- On mesure enfin l’absorbance des différents mélanges colorés à 580 nm
après avoir réalisé un blanc grâce à un échantillon témoin. Les
résultats obtenus sont les suivants :
Cm(mg/L)
|
0
|
0,1
|
0,5
|
2,0
|
3,0
|
5,0
|
A
|
0
|
0,03
|
0,17
|
0,67
|
1,00
|
1,67
|
On réalise le même protocole pour le filtrat obtenu lors du traitement du matériau étudié, on obtient A = 1,34.
2.1. Pourquoi chauffe-t-on le mélange lors de la troisième étape de la préparation des solutions étalons ?
La température est un facteur cinétique ; en chauffant le mélange réactionnel, on accélère la réaction chimique.
2.2. Quelle est la couleur du composé coloré formé lors de cette réaction ?
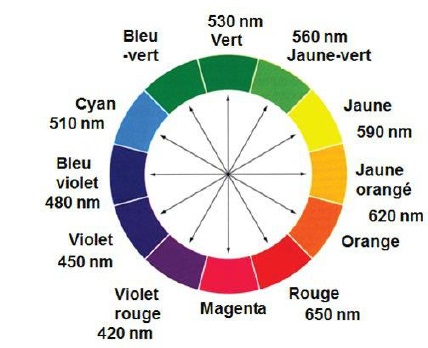
Le maximum d'absorption se situe à 580 nm (jaune). B possède la couleur complémentaire du jaune, c'est à dire le violet.
2.3. Déterminer la valeur de la
concentration massique minimale de l’acide chromotropique pour que
celui-ci soit en excès sur toute la gamme d’échantillons utilisés.
M(acide chromotropique) = 320 g / mol.
5 mg / L en formaldehyde pour la solution la plus concentrée, dans 3,0 mL
Soit 5 / M(CH2O) = 5 / 30 = 0,167 mmol / L
0,167 x 3,0 10-3 = 5,0 10-4 mmol.
n((acide chromotropique) = 2 x 5,0 10-4 =1,0 10-3 mmol dans 0,3 mL ; 1,0 10-3 / 0,3 = 3,33 10-3 mol /L.
3,33 10-3 x 320 ~1,1 mg / L.
|
|
|
........
|
|
2.4. Exploitation du dosage
2.4.1. Déterminer, par une méthode de votre choix, la concentration massique en formaldéhyde dans le filtrat étudié.
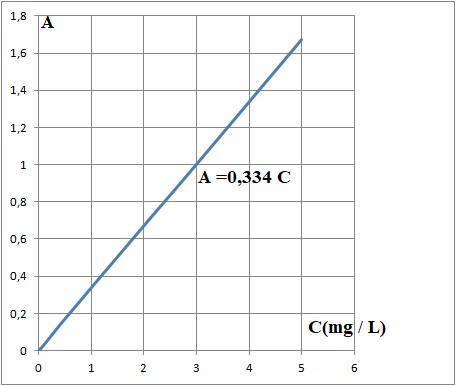
C = 1,34 / 0,334 = 4,0 mg / L.
2.4.2. Depuis 2002
la norme E1 impose pour les différents matériaux des teneurs en
formaldéhyde inférieures ou égales à 8 mg pour 100 g de matériau.
L’échantillon étudié satisfait-il à cette norme ?
4,0 *0,300 =1,2 mg de formaldehyde dans 300 mL d'eau ou dans 30,0 g de matériau.
1,2 / 30 x 100 = 4 mg pour 100 g.
Cette valeur étant inférieure à 8 mg pour 100 g, la norme est respectée.
|
|
|