De
la noix de muscade à la cosmétique,
bac S Métropole 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
La
noix de muscade contient divers triglycérides dont la trimyristine qui
permet d’obtenir le myristate d’isopropyle. Ce dernier trouve de
nombreuses utilisations en cosmétique et entre dans la composition de
ce qu'on appelle "l’alcool des parfumeurs", support de dilution très
utilisé en parfumerie.
Le but de cet exercice est de comprendre comment, à partir de la trimyristine extraite de noix de muscade,
on peut obtenir l’acide myristique nécessaire à l’obtention du myristate d’isopropyle.
La trimyristine est un triglycéride dont on donne une représentation ci-dessous.
Les trois groupes identiques, notés R, sont de longues chaines carbonées.
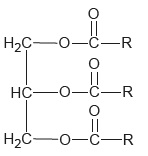
1. Extraction de la trimyristine à partir de la noix de muscade.
Une masse de trimyristine mtrimyristine = 4,75 g a été extraite de 20,0
g de noix de muscade en utilisant le protocole décrit ci-dessous.
Étape 1 :
dans un ballon de 250 mL, mélanger 20,0 g de poudre de noix de muscade
et 100 mL de dichlorométhane. Chauffer à reflux pendant 30 minutes.
Étape 2 :
filtrer sous hotte aspirante le contenu du ballon et rincer ce dernier
avec 20 mL de dichlorométhane. Évaporer le solvant à l’aide d’un
montage de distillation simple. Le ballon contient alors environ 10 mL
de liquide jaune huileux.
Étape 3 :
ajouter progressivement 50 mL de propanone dans le ballon afin de
dissoudre à chaud le contenu du ballon. Quand la solution est devenue
homogène, placer le ballon dans un bain d’eau glacée. On observe
progressivement la formation d’un solide blanc.
Étape 4 : filtrer sur Büchner, sécher à l’étuve le solide blanc obtenu et mesurer sa masse.
1.1. Donner deux arguments qui peuvent justifier l'utilisation du dichlorométhane plutôt que de l'éthanol lors des étapes 1 et 2.
La trimyristine est plus soluble dans le dichlorométhane que dans l'éthanol.
La température d'ébullition du dichlorométhane est de 40 °C, alors que celle de l'éthanol est de 78°C.
Le dichlorométhane demande moins d'énergie pour son évaporation ( étape 2).
1.2. Justifier l'observation faite dans l'étape 3.
La trimyristine est soluble à chaud dans la propanone, mais insoluble à froid.
1.3. La masse de trimyristine obtenue est-elle en accord avec les données ? Justifier.
Le pourcentage massique en trimyristine dans la poudre de noix de muscade est compris entre 20 % et 25 %.
20,0 x0,20 = 4,0 g ; 20,0 x0,25 = 5 g.
On a obtenu 4,75 g de trimyristine, cette valeur est en accord avec les données.
2. Obtention de l'acide myristique.
On fait réagir la trimyristine avec un excès d'ion hydroxyde.
2.1. Donner la formule semi-développée du glycérol.
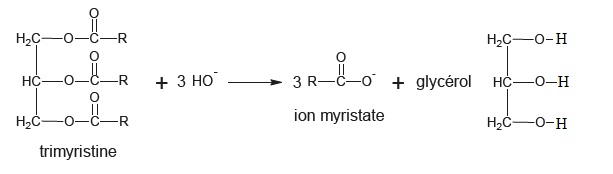
2.2. Retrouver la formule brute des trois groupements R.
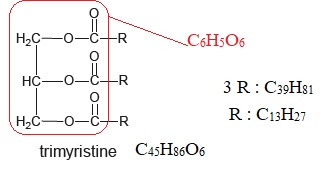
La trimyristine contient trois groupements ester.
2.3 Représenter les
flèches courbes rendant compte de l'hydrolyse basique d'un ester. Citer
la catégorie de réaction de cette étape.
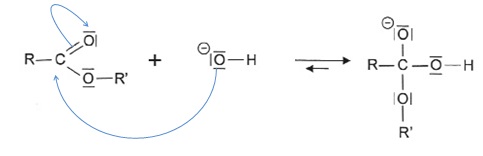
Addition sur la double liaison C=O.
On fait agir les ions myristiate avec les ions oxonium apportés par
l'acide chlorhydrique à 1,0 mol/L jusqu'à ce que la solution atteigne
un pH voisin de 1.
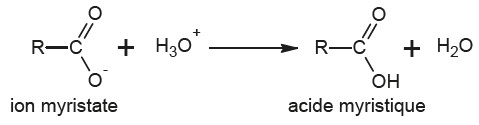
2.4. Donner en justifiant la forme prédominante du couple acide myristique / ion myristate ( pKa = 5) en fin d'ajout.
A pH inférieur au pKa, la forme acide myristique prédomine.
A la fin de la synthèse et après séchage on obtient m = 3,36 de produit supposé pur.
2.5 Déterminer
la quantité de matière maximale d'acide myristique que l'on pouvait
obtenir et déterminer le rendement de cette synthèse.
n(trimyristine) =4,75 / M(trimyristine ) = 4,75 / 723 =6,57 10-3 mol.
Quantité de matière maximale d'acide myristique 3 x 6,57 10-3 = 1,97 10-2 mol.
Masse correspondante : 1,97 10-2 M(acide myristique) = 1,97 10-2 x 228 =4,49 g.
Rendement = masse réell / masse théorique = 3,36 / 4,49 ~0,75 ( 75 %).
|
|
|
.
|
|
........
|
|
3. Détermination par titrage de la pureté de l’acide myristique obtenu.
En réalité le produit obtenu n’est pas forcément pur. Afin d’estimer la
pureté du produit obtenu lors de la synthèse précédente, on en prélève
un échantillon de masse méch = 1,14 ± 0,01 g. Cet échantillon est entièrement dissout dans un solvant approprié pour préparer une solution appelée S1 dans une fiole jaugée de volume V0 = 100,00 ± 0,08 mL.
On réalise le titrage acido-basique suivi par colorimétrie d’une prise d’essai V1 = 10,00 ± 0,05 mL de la solution S1 par une solution d’hydroxyde de sodium, (Na+(aq) + HO-(aq)), de concentration molaire égale à C2 = (5,00 ± 0,01) × 10-2 mol·L-1. Lors de ce titrage, l’équivalence est obtenue pour un volume versé VE = 9,60 ± 0,05 mL.
3.1. Écrire l'équation de la réaction support du titrage de l’acide myristique par l'hydroxyde de sodium.
RCOOH aq + HO-aq ---> RCOO-aq +H2O(l).
3.2. Déterminer la concentration massique d’acide myristique de la solution titrée.
A l'équivalence : [RCOOH] = C2VE / V1 =5,00 10-2 x9,60 / 10,00 = 4,80 10-2 mol/L.
3.3. En déduire la masse d’acide myristique mexp présente dans la solution S1.
4,80 10-3 mol dans 100 mL de S1 soit : 4,80 10-3 x 228 =1,094 ~1,09 g..
3.4. On admet que, dans les conditions de l’expérience, l’incertitude relative U(mexp) / mexp satisfait à la relation :
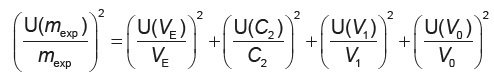
Proposer un encadrement de la masse mexp d’acide myristique et comparer avec la masse initialement dissoute méch dans la solution S1. Commenter.
[U(mexp) / mexp]2 =(0,05 / 9,60)2 +(0,01 / 5)2 +(0,05 /10)2 +(0,08 /100)2 =5,66 10-5 ;
U(mexp) / mexp= 7,53 10-3 ; U(mexp) = 7,53 10-3 x1,094 ~9 10-3 g.
mexp= 1,094 ±0,009 g.
1,085 < mexp < 1,103 g
De plus : 1,14 ± 0,01 g soit 1,13 < mexp < 1,15 g.
Ces deux intervalles ne se recoupent pas. l'acide n'est pas pur.
3.5. Déterminer le degré de pureté du produit synthétisé.
Le degré de pureté d d’un produit dans un échantillon est le rapport
entre la masse du produit contenu dans l’échantillon et la masse de
l’échantillon soit : d = 1,094 / 1,14 ~0,96 ( 96 %).
|
|
|