Le biodiesel,
controle de la qualité d'un lait, bac STL- SPCL
2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
Le biodiesel.
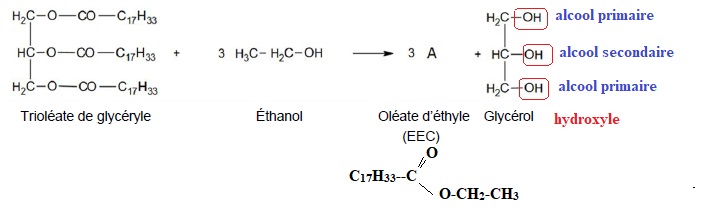
L'huile de colza est constituée majoritairement de trioléate de
glycéryle. Sa transestérification s'effectue en milieu basique et en
présence d'un excès d'éthanol. On donne l'équation chimique modélisant
cette transformation.
1. Entourer les groupes caractéristiques du glycérol et nommer les fonctions chimiques associées.
2. Donner la formule semi-dveloppée de la molécule A.
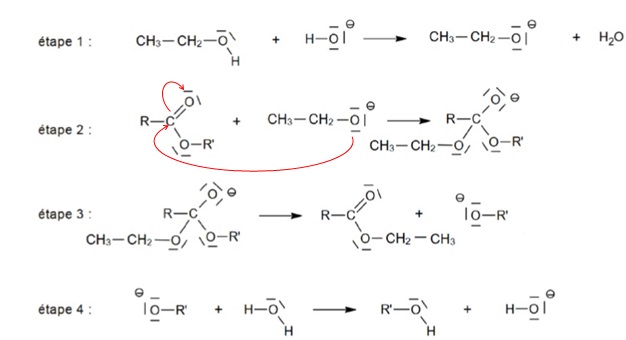
On donne les étapes élémentaires du mécanisme réactionnel.
3. Indiquer ce que représentent les flèches courbes dans l'écriture du mécanisme.
Une flèche courbe indique le déplacement d'un doublet d'électrons.
4. Compléter par des flèches courbes l'étape 2.
5. Ecrire l'équation de la réaction chimique modélisant la transestérification.
C57H104O6 +3C2H6O -->3 C20H38O2 +C3H8O3.
1150 kg d'huile de colz permettent d'obtenir 1200 L d'EEC.
6. Montrer que la masse d'EEC est 1,06 103 kg et en déduire la quantité de matière d'EEC.
Masse volumique d'EEC : 880 g / L = 0,880 kg / L
1200 x 0,880 =1056 ~1,06 103 kg.
M(EEC) = 310 g / mol.
nEEC =masse (g) / M(EEC) = 1056 x1000 / 310 =3406,45 ~3,41 103 mol.
7.
La valeur maximale de la quantité de matière d'EEC qu'il est possible d'obtenir est nmax = 3,90 103 mol. Déterminer le rendement.
nEEC / nmax = 3,41 / 3,90 ~0,874 ( 87,4 %).
8. Expliquer l'intérêt d'un excès d'éthanol.
Lorsqu'un réactif est en excès ( de préférence le moins couteux ), l'équilibre est déplacé dans le sens direct, formation d'EEC.
Le bioéthanol utilisé est obtenu par fermentation de matières végétales. On réalise le spectre RMN de ce bioéthanol.
9. Montrer que le nombre de signaux présents est en accord avec la formule semi-développée de l'athanol.
Justifier la multiplicité de chaque signal.
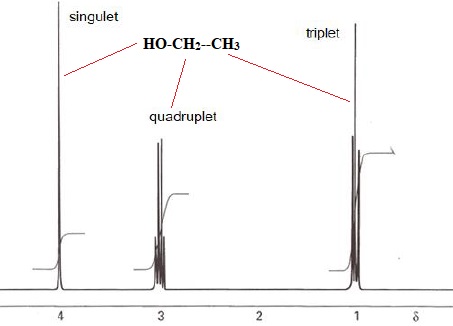
Groupe CH3 : le carbone voisin compte 2 protons ; le signal de ce groupe est un triplet.
Groupe CH2 : le carbone voisin compte 3 protons ; le signal de ce groupe est un quadruplet.
|
Contrôle de la qualité d'un lait.
L'acide
lactique provient de la dégradation du lactose. Plus un lait est frais,
moins il contient d'acide lactique. la concentration en acide lactique
dans un lait s'exprime en degré Dornic : 1 °D correspond à 0,1 g
d'acide lactique par litre de lait. Un lait frais contient de 15 à 18
°D, il caille à 60 - 70 °D.
1. Justifier
le fait que l'acide lactique présente des stéréoisomères, puis les
représenter et préciser la relation de stéré-isomèrie qui les lie.
La présence d'un atome de carbone asymétrique conduit à l'existence de 2 énantiomères.
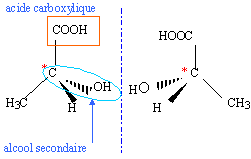
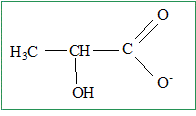
2. Représenter la formule semi-développée de l'ion lactate, base conjuguée de l'acide lactique.
On réalise le titrage
pHmétrique d'un volume V = 10,00 mL de ce lait auquel on ajoute 40 mL
d'eau par une solution étalonnée d'hydroxyde de sodium de
concentration COH- = 0,015 mol / L. On obtient la courbe suivante.
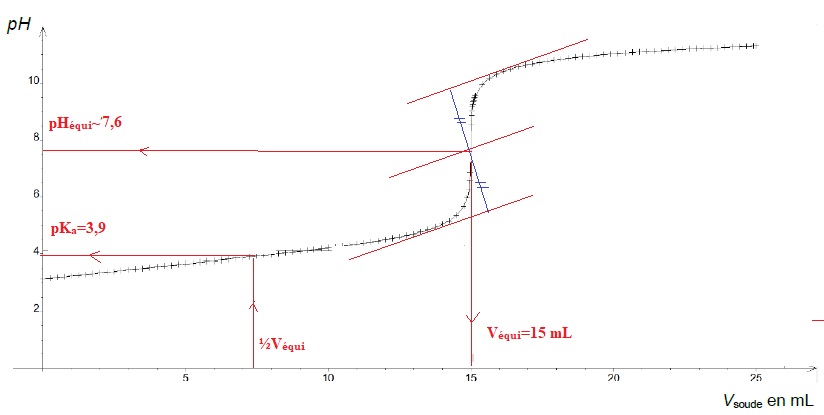
3. Indiquer
quelle est l'espèce du couple acide lactique / ion lactate présente
majoritairement au dénut du titrage d'une part et en fin de titrage
d'autre part.
pKa(acide lactique / ion lactate)=3,90.
Au début, le pH est voisin de 3 ; à pH < pKa, l'acide lactique est majoritaire.
A la fin, le pH est supérieur au pKa et l'ion lactate prédomine.
4. En déduire l'équation support du titrage.
H3C-CHOH-COOH aq + HO-aq --> H3C-CHOH-COO- aq + H2O(l).
5. Déterminer le volume à l'équivalence.
La méthode des tangentes donne Véqui = 15 mL.
6. Estimer graphiquement une valeur du pKa.
7.
Déterminer la concentration C en acide lactique du lait analysé.
Exprimer le résultat en tenant compte d'une incertitude type égale à 3
10-4 mol / L.
8. Le lait est-il frais ?
A l'équivalence, quantité de matière d'ion hydroxyde ajouté : CHO- Véqui =0,015 x 15 = 0,225 mmol.
Quantité de matière d'acide lactique : 0,225 mmol dans 10,0 mL.
C = 0,225 / 10,0 = 0,0225 mol/ L =2,25 10-2±0,03 mol / L .
M(acide lactique) = 90,1 g / mol.
Titre massique en acide lactique : 90,1 x0,0225 =2,03 g soit environ 20 °D. Ce lait n'est pas frais.
9. Proposer un indicateur coloré permettant de réaliser ce titrage.
Le pH du point équivalent ( 7,6 dans ce cas) doit appartenir à la zone de virage de l'indicateur coloré.
Le bleu de bromothymol peut convenir.( à l'équivalence, passage du jaune au bleu ).
|
|





