Le but de cet exercice est d’étudier la synthèse d’un « biocarburant », l’ester méthylique de colza.
La synthèse de ce biocarburant nécessite de l’huile de colza et du méthanol comme réactifs. Elle est
modélisée par la réaction d’équation suivante :
C
57H
98O
6 + 3 CH
3OH → 3 C
19H
34O
2 + C
3H
8O
3.
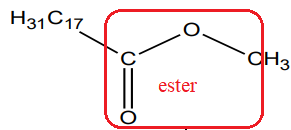
La formule semi-développée de l’ester méthylique de colza est donnée.
L’ester méthylique de colza
1. Après avoir recopié la formule semi-développée de l’ester méthylique de colza, entourer le groupe
caractéristique présent dans la molécule.
 2.
2. Déterminer la masse molaire moléculaire de l’ester méthylique de colza.
M = 19 x12 +2 x16 +34 =294 g / mol.
Analyse du protocole de synthèse.
1. Mettre l'huile de colza dans le ballon, puis ajouter le méthanol et le catalyseur (soude).
2. Porter le contenu du ballon à 60 °C et chauffer à reflux pendant une heure environ en homogénéisant
à l’aide de l'agitateur magnétique.
3. Lorsque l’agitation et le chauffage sont arrêtés, deux phases sont visibles. Les séparer par
décantation.
4. La phase organique est récupérée, puis lavée par une solution aqueuse saturée de chlorure
d’ammonium et enfin séchée sur du sulfate de sodium anhydre.
5. Les dernières traces de méthanol sont retirées par évaporation sous une hotte aspirante.
6. Mesurer la masse et le volume du produit de synthèse obtenu.
3. Identifier, dans le protocole, les conditions opératoires destinées à augmenter la vitesse de synthèse
de l’ester méthylique de colza.
Chauffer à reflux à 60°C ( la température est un facteur cinétique).
Présence d'un catalyseur.
Agitation.
4. Identifier, dans le protocole de synthèse, les étapes correspondant à la transformation des réactifs,
et à la séparation du produit, en les associant aux numéros des étapes du protocole.
Transformations des réactifs : étape 1.
Séparation et purification du produit : étapes 3, 4 et 5.
Analyse du produit formé.
Le produit synthétisé a une masse 𝑚 = 72,9 ± 0,1 g et un volume 𝑉 = 82,0 ± 0,1 mL.
L’incertitude-type 𝑢(
r) sur la masse volumique
r se déduit des valeurs et incertitudes sur la masse 𝑚 et le
volume 𝑉 par l’expression suivante :
(
𝑢(
r) /
𝜌
)
2
= (
𝑢(𝑚)
/𝑚
)
2
+ (
𝑢(𝑉)
/ 𝑉
)
2.
2
5. Déterminer la valeur de la masse volumique du produit obtenu lors de la synthèse.
r = m / V =72,9 / 82,0 =0,889 g / mL.
6. Écrire le résultat de la détermination expérimentale de la masse volumique avec son incertitude
associée.
(
𝑢(r) /
𝜌
)
2
= (0,1 / 72,9
)
2
+ ( 0,1
/ 82
)2 =1,88 10-6 +1,49 10-6 =3,37 10-6.
𝑢(r)
/ 𝜌
=1,8 10-3.
𝑢(r) = 1,8 10-3 x 0,889 =1,6 10-3 ~ 2 10-3 g / mL.
r =(889 ± 2 ) 10-3 g / mL.
7. Comparer le résultat expérimental de la masse volumique avec la valeur de référence du produit
synthétisé en utilisant le quotient |
r−
r𝑟𝑒𝑓|
/ 𝑢(
r)
.
|r−r𝑟𝑒𝑓|
/ 𝑢(r)=(0,889 -0,880) / (2 10-3 ) =4,5. ( 4,5 %).
A 4,5 % près ces deux résultats sont cohérents.
Rendement de la synthèse.
9. Montrer que le méthanol est le réactif introduit en excès et déterminer la masse maximale d’ester
méthylique de colza pouvant être théoriquement obtenue si la transformation est totale et le produit
entièrement récupéré.
Huile de colza commerciale (𝑚
1 = 100,0 g),
M
1 =878 g / mol.
n
1 =100 / 878 ~0,114 mol.
Méthanol (𝑚
2 = 25,0 g ; M
2 =32,0 g / mol).
n
2 =25 /32 ~ 0,78 mol, en large excès.
Quantité théorique d'ester : n
th =3 x 0,114 =0,342 mol.
10. Définir, puis calculer le rendement de cette synthèse.
Rendement = Quantité de matière réelle d'ester / quantité de matière théorique.
n
réelle = 72,9 / 294 =0,248 mol.
Rendement = 0,248 / 0,342 ~0,73 ( 73 %).
.