Volume de boisson étudiée contenu dans un verre de cocktail : V = 3,0 cL ou 0,03 L.
Concentration en masse de sucre dans cette boisson : 367 g / L.
Masse d'un morceau de sucre : 5,0 g.
Q1.
Déterminer le nombre de morceaux de sucre équivalent à la quantité de
sucre apporté par la boisson lorsqu'on boit un verre de cocktail.
Masse de sucre dans un verre : 367 x 0,03 = 11 g soit 2 morceaux de sucre, quantité très faible.
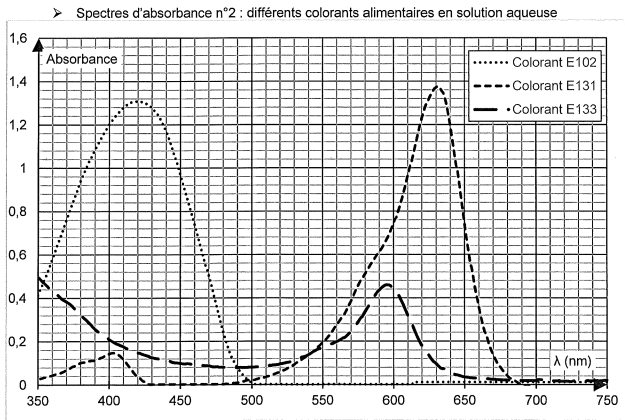
La couleur verte de la boisson est obtenue par le mélange de 2
colorants alimentaires. On cherche à les identifier parmi les trois
colorants analysés dans le spectre d'absorbance suivant.
 Q2.
Q2. Indiquer la couleur en solution aqueuse de chaque colorant alimentaire.
E102 : le maximum d'absorption se situe vers 430 nm ( violet). Ce
colorant possède la couleur complémentaire du violet, c'est à dire le
jaune.
E133 : le maximum d'absorption se situe vers 595
nm ( orange). Ce colorant possède la couleur complémentaire de l'orange,
c'est à dire le bleu.
E131 : le maximum d'absorption se situe vers 630
nm ( orange rouge). Ce colorant possède la couleur complémentaire de l'orange rouge
c'est à dire le bleu vert.
Q3. Déterminer les deux colorants majoritairement présents dans cette boisson.
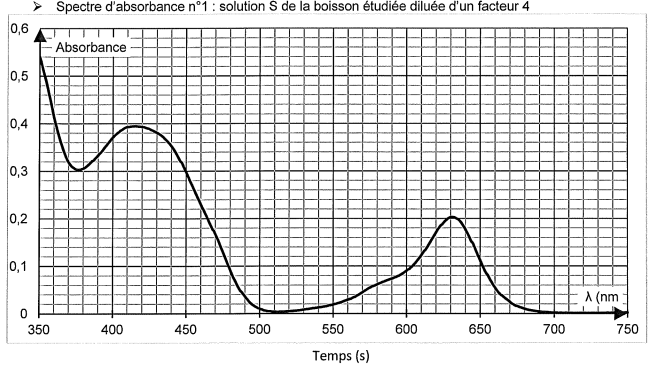
Le spectre de la boisson présente deux maximum d'absorption vers 420 nm
et vers 630 nm. Les colorants se trouvant dans la boisson sont
majoritairement E102 et E 131.
Pour le colorant E102 la dose journalière admissible ( DJA) est de 7,5 mg par kilogramme de masse corporelle et par jour.
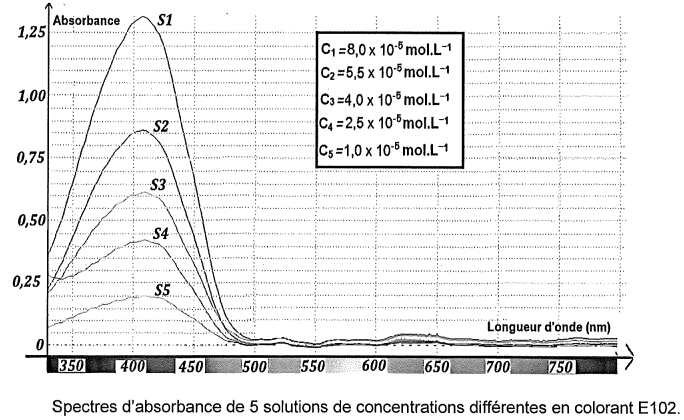
Pour déterminer la concentration de ce colorant dans cette boisson, on
réalise une gamme de solutions étalons de concentrations différentes à
partir d'une solution mère S
0 de colorant E102. On enregistre les spectres d'absorbance correspondants.
Pour doser E102 dans la boisson, les spectres obtenus sont exploités à 450 nm.
 Q4.
Q4. Expliquer le choix de 450 nm plutôt que 420 nm.
E102 présente une absorbance A = 1 vers 450 nm et A = 1,3 vers 420 nm.
E102 présente une absorbance A = 0 vers 450 nm et A = 0,15 vers 420 nm.
Seul le colorant E102 est responsable de l'absorbance de la solution vers 450 nm.
On rappelle que le spectre d'absorbance n° 1 est celui de la boisson
étudiée obtenue après dilution d'un facteur 4 de la solution
commerciale.
Fiole jaugée de 100 mL et pipette jaugée de 100 / 4 = 25 mL.
Q 5. Proposer un ensemble de verrerie permettant de préparer S à partir de la solution commerciale.
Fiole jaugée de 100 mL et pipette jaugée de 100 / 4 = 25 mL.
Becher, pisette d'eau distillée.
Q 6. Montrer que pour la longueur d'onde choisie de 450 nm, la loi de Beer-Lambert est vérifiée pour le colorant E102.
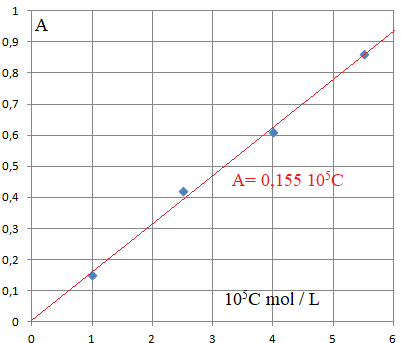
L'absorbance étant proportionnelle à la concentration, cette loi est vérifiée.
Q.7. Déterminer la masse de colorant E102 contenue dans un verre de coktail et commenter.
Absorbance de la solution S : A = 1,3.
C = 1,3 / (0,155 10
5) ~8,4 10
-5 mol / L.
Tenir compte de la dilution : 8,4 10
-5 x4 =3,36 10
-4 mol / L.
Masse molaire du colorant E 102 : M = 534 g / mol.
Concentration massique : 534 x3,36 10-4 =0,18 g / L.
Soit dans un verre ( 0,03 L) : 0,18 x0,03 =5,3 10-3 g ou 5,3 mg.
La DJA de ce colorant étant de 7,5 mg par kg de masse corporelle par jour, celle-ci n'est pas dépassée.



