Le terme « sonochimie » est utilisé pour décrire les transformations chimiques qui se produisent en
solution grâce à l’énergie apportée par des ultrasons dont la fréquence doit être comprise entre 20 kHz
et 1 MHz.
La sonochimie permet de réaliser des transformations chimiques à haut rendement et de minimiser la
quantité de déchets.
Dans certains cas, l'utilisation des ultrasons permet d'obtenir des produits différents
de ceux obtenus sans ultrasons.
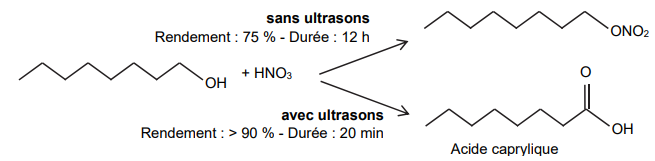
On s’intéresse à la transformation entre l’octan-1-ol et l’acide nitrique en présence ou absence
d’ultrasons. Les schémas correspondants aux deux transformations sont représentés ci-dessous :
pK
A du couple acide-base auquel appartient l’acide caprylique, à 25°C : 4,9.
Octan-1-ol : 130 g / mol ; masse volumique 0,82 g / mL.
Acide nitrique : 63 g / mol ; solution aqueuse à 65 % en masse ; 1,4 g / mL.
Acide caprylique :M = 144 g / mol.
1. L’acide caprylique.
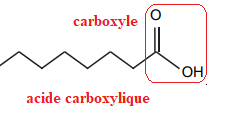
1.1. Recopier la formule topologique de l’acide caprylique et entourer son groupe caractéristique.
Nommer la fonction chimique associée.
 1.2.
1.2. L’acide caprylique, noté R-CO
2H, est naturellement présent dans la noix de coco et est très peu
soluble dans l’eau. À 25°C, on dissout 0,68 g d’acide caprylique dans 1,00 L d’eau. Le pH de la
solution obtenue est de 3,6.
1.2.1. Écrire l’équation de la réaction acide-base modélisant la transformation entre l’acide
caprylique et l’eau.
RCO
2H aq + H
2O (l) = RCO
2- aq + H
3O
+aq.
1.2.2. Déterminer le taux d’avancement de cette transformation. En déduire si l’acide caprylique est
un acide fort ou un acide faible.
[H3O+aq]=[RCO2- aq] =10-pH = 10-3,6 ~2,5 10-4 mol / litre.
Concentration apportée en acide caprylique : 0,68 / 144 ~4,7 10-3 mol / L.
Taux d'avancement : 2,5 10-4 / (4,7 10-3) ~0,053.
Le taux d'avancement est très inférieur à 1, cet acide est faible.
1.2.3. Représenter le diagramme de prédominance du couple auquel appartient l’acide caprylique.
En déduire la forme prépondérante dans la solution préparée.
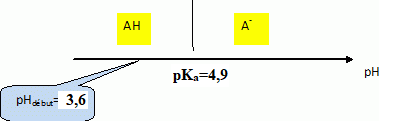
A pH < pK
a, la forme acide AH prédomine.
.