Concours
externe adjoint technique de recherche et de formation principal
Poitiers 2016.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
A. Physique.
1. Compléter le tableau ( 5,5 points).
Symbole de l'unité
|
Nom
|
Grandeur physique
|
A
|
ampère
|
intenité
|
V
|
volt
|
tension
|
N
|
newton
|
force
|
Pa
|
pascal
|
pression
|
W
|
watt
|
puissance
|
W
|
ohm
|
résistance électrique
|
S
|
siemens
|
conductance électrique
|
K
|
Kelvin
|
température
|
J
|
joule
|
énergie
|
dB
|
décibel
|
niveau sonore
|
Hz
|
hertz
|
fréquence
|
2. Indiquer le facteur multiplicateur correspondant à chaque préfixe. ( 2pts)
nano : 10-9 ; micro : 10-6 ; giga : 109 ; kilo : 103.
3. Convertir : (2 pts)
0,2 L = 200 mL ; 0,06 mg = 6 10-5 g =6 104 ng ;
II. Résistance et calcul d'intensité.
On réalise un montage comprenant un générateur de courant continu, un interrupteur et une résistance.
1. Faire le schéma.(1 pt)
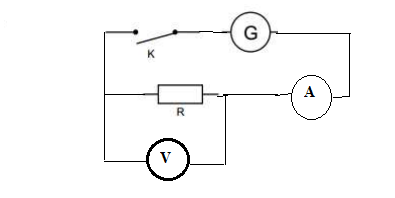
2. Nommer l'appareil permettant la mesure de l'intensité. Le nommer et le représenter.(1,5 pts)
Ampèremètre en série.
3. Nommer l'appareil permettant la mesure de la tension aux bornes de la résistance. Le nommer et le représenter. (1,5 pts)
Voltmètre en dérivation.
4. Calculer R si i = 475 mA et U = 12,5 V ( 1 pt)
R = U / I = 12,5 / 0,475 ~ 26 ohms.
III Condensateur.
Le montage suivant permet d'étudier la charge et la décharge d'un condensateur.
E = 5,0 V ; R=R' = 3,3 kW ; C = 1,6 10-6.
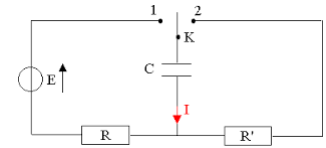
1. Quel est le nom de la caractéristique C du condensateur ? Préciser son unité. (1 pt)
Capacité en farad (F).
2. Quel est le phénomène étudié quand on bascule l'interrupteur de la position 1 en position 2 ? Justifier. (2 pts).
Position1 depuis assez longtemps : charge du condensateur.
En position 2 : décharge du condensateur dans R'.
3. Citer une application d'utilisation d'un condensateur. ( 1 pt).
Stockage d'énergie électrique.
4. Calculer t = RC ( 1pt).
RC = 3,3 103 x 1,6 10-6 =5,28 10-3 seconde.
IV. Ultrasons.
1. Quel est l’ordre de grandeur de la célérité d’une onde ultrasonore dans l’air et
dans l’eau ? (1 pt)
Dans l'eau : 1500 m /s ; dans l'air : 340 m /s.
2. Dans quel domaine de fréquences se situent les ultrasons ?
20 kHz à 10 000 kHz.
3 Quel est le matériel nécessaire pour déterminer la vitesse des ultrasons dans
l’air ? Vous schématiserez le dispositif expérimental. (2 points)
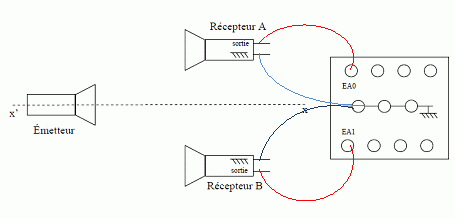
Le récepteur A est relié à la voie E A0 du boîtier
d'acquisition, le récepteur B à la voie E A1.
On déplace ensuite le récepteur B, dans la direction
émetteur-récepteur, d'une distance d suffisamment grande pour pouvoir
mesurer avec précision le retard ultrasonore Δt correspondant au
passage de l'onde par les deux récepteurs. Le déplacement s'effectue
selon un axe parallèle à l'axe x'x du schéma simplifié du montage .
Afin de déterminer la célérité des ondes ultrasonores, on réalise une
acquisition (sur une durée inférieure à celle d'une salve) pour une
distance d = 0,3 m.
|
...
|
....
|
Optique.
On dispose d’un banc d’optique gradué avec des accessoires fixés sur des supports
adaptés ; des lentilles avec les indications +16δ, +8δ, +5δ, +3δ, +2δ, -3δ, -2δ, -8δ ; un
écran blanc ; un diaphragme ; un miroir plan ; une source laser, un objet lumineux de
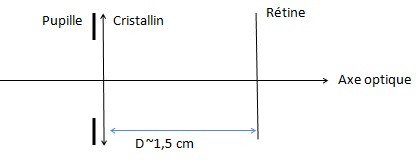
petite taille. Quel(s) matériel(s) faut-il pour modéliser simplement l’œil ? Vous
schématiserez le modèle de l’œil. (2 points).
L'oeil réduit est constitué de trois éléments :
- un diaphragme correspondant à la pupille ;
- une lentille convergente correspondant au cristallin ,
- un écran correspondant à la rétine.
La distance rétine - cristallin est fixe.
Spectroscopie
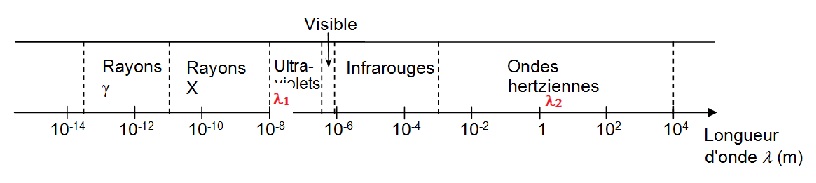
Indiquer sur le schéma, où se situent les rayonnements UV, X et IR. (1,5 points)
Chimie
Les éléments .
1 Donner, en justifiant, le nombre de protons, neutrons, électrons et nucléons de
l’atome dont le noyau s’écrit : (2 points)
2311Na
23 nucléons ; 11 protons ; 11 électrons et 23-11 = 12 neutrons.
2 Compléter le tableau. (3 points).
Nom
|
Symbole
|
sodium
|
Na
|
Bore
|
B
|
carbone
|
C
|
soufre
|
S
|
azote
|
N
|
mercure
|
Hg
|
3 Compléter les noms et formules chimiques des ions suivants. (3 points)
Ion sodium Na+ ; ion potassium K+ ; ion sulfate SO42- ;
I- ion iodure ; ion hydroxyde HO- ; Ion oxonium H3O+.
Réactions Chimiques
Equilibrez les réactions suivantes : (2 points)
4 CO + Fe3O4 --> 4 CO2 + 3 Fe.
MnO4- + 8H+ + 5 e- --> Mn2+ + 4H2O.
2C4H10 + 13O2 -->8CO2 + 10H2O.
Quelle loi utilise-t-on pour déterminer une concentration à partir d’une absorbance ?
Donner l’équation et préciser les unités de chaque grandeur. (2 points).
Loi de Beer-Lambert A = e l c
.où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
Que signifient les lettres pH ? Ecrire l’équation reliant le pH à la concentration en ions
oxoniums. Calculer la concentration d’une solution d’acide chlorhydrique de pH 2. (2
points)
pH : potentiel hydrogène.
pH = - log[H3O+].
[H3O+] = 10-pH = 10-2 mol/ L
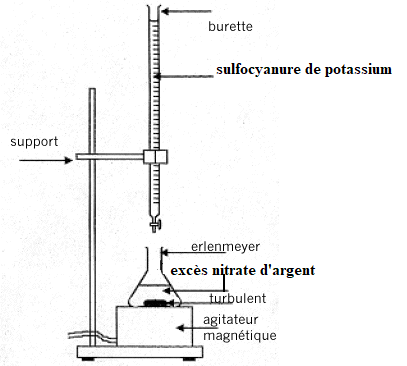
Dosage des ions chlorures.
Un professeur d’une classe de terminale STL dépose au laboratoire un protocole de TP. Il
souhaite doser par la méthode de Charpentier-Vohlard, les ions chlorures présents dans l’eau
de mer.
Préparation du matériel :
Après dilution de l'échantillon d'eau de mer à doser, on effectue un dosage en retour : à la
prise d'essai de la solution diluée d'eau de mer, on verse une quantité connue et en excès de
nitrate d'argent. L'excès d'ions argent est alors dosé par les ions sulfocyanure SCN-
. La fin du
dosage est mise en évidence par un indicateur coloré contenant des ions Fer III (alun
ammoniacal FeNH4(SO4)2 ) à 5 % avec l'apparition de la couleur rouge du complexe
FeSCN2+.
Le protocole est le suivant :
Dans un erlenmeyer de 150 ml, on verse 5 ml de solution d'eau de mer diluée au 10ème
,
20 mL d'eau déminéralisée, 2 mL d'acide nitrique dilué au demi et 20 mL de nitrate d'argent
[Ag+] = (0,025+0,003) mol.L-1
. Chauffer doucement le mélange sur une plaque chauffante,
laisser revenir à température ambiante, sous sorbonne. Avant dosage, ajouter 1 ml
d’indicateur coloré. Puis doser par une solution de sulfocyanure de potassium de
concentration voisine de (0,025 + 0,002) mol.L-1.
1. Citer le matériel nécessaire à la réalisation de l’ensemble du protocole. (2
points)
2. Décrire la préparation de la solution diluée d’eau de mer. (2 points).
Prélever 10 mL d'eau de mer ( pipette jaugée). Verser dans une fiole
jaugée de 100 mL et compléter à l'aide d'eau distillée jusqu'au trait
de jauge. Agiter pour rendre homogène.
3. Ecrire les équations des réactions mises en jeu au cours du dosage et l’équation
de réaction de l'indicateur. (3 points)
Ag+ aq+ SCN-aq --->AgSCN- aq. réaction support du titrage.
FeNH4 4+aq +SCN-aq --->FeSCN2+aq + NH4+aq. (indicateur coloré).
4. Etablir (en justifiant) les expressions littérales de la concentration en ions
chlorure de la solution diluée et de son incertitude. (2 points).
n(Ag+)ajouté =
20 [Ag+] mmol.
n(Ag+)titré =[sulfocyanure) V éq.
n(Cl-) =n(Ag+)ajouté -n(Ag+)titré =20 [Ag+] -[sulfocyanure) V éq.
[Cl-] =-n(Cl-) / 5 puis multiplier par 10.
Incertitude / [Cl-] = [(0,003 / 0,025)2 +(0,002 / 0,025)2]½=0,14 ~0,2.
5. Pour le dosage, chaque élève utilise un volume de solution aqueuse de nitrate
d’argent égal à 110 mL. Les deux groupes de TP sont constitués chacun de 12
étudiants travaillant en binôme. Déterminer le volume total de solution de nitrate
d’argent à préparer. (1 point)
12 binômes soit 12 x 110 =1,32 L.
Chimie Organique
1 Le pentane a pour formule C5H12.
On donne les masses atomiques suivantes C= 12g/mol, H = 1g/mol
- Calculer sa masse moléculaire (1 point)
5 x12 +12 =72 g / mol.
- Ecrire la formule semi-développée de la molécule (1 point)
CH3-CH2-CH2-CH2-CH3.
La réaction de l’acide heptanoique C7O2H14 et de l’éthanol produit un arôme
artificiel qui a l’odeur du cognac.
- Ecrire la formule semi-développée de l’acide heptanoique (1 point)
CH3-CH2-CH2-CH2-CH2-CH2-COOH.
- Quel est le groupement fonctionnel des acides carboxyliques (1 point)
COOH groupe carboxyle.
- Ecrire la formule semi-développée de l’éthanol (1 point)
CH3-CH2OH.
- Ecrire l’équation bilan de la réaction de l’acide heptanoique et l’éthanol et
donner le nom de la réaction (1 point)
CH3-CH2-CH2-CH2-CH2-CH2-COOH + CH3-CH2OH =CH3-CH2-CH2-CH2-CH2-CH2-COO-CH2-CH3 + H2O.
Hygiène et sécurité.
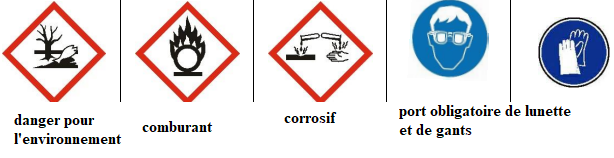
-Donner la signification de chaque pictogramme présent sur le flacon de nitrate
d’argent,
Citer 3 types d’extincteurs et associer les à leur domaine d’application (3 points)
classe A (eau pulvérisée + additifs, poudre sèche): feux secs.
Classe B :(eau pulvérisée + additifs, poudre sèche) feux gras avec liquides et solides devenant liquides à température élevée.
Classe C (poudre sèche, dioxyde de carbone): feux de gaz.
Classe D (poudre D): feux de métaux.
Que signifient les lettres SGH ?
système général harmonisé.
Que signifient les lettres pour un produit classé CMR ?
cancérogène, mutagène, reprotoxique.
|
|