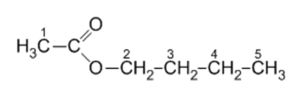Physique
chimie,
concours ITRF Lyon 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Chimie.
Exercice 1.
Donner le symbole chimique des éléments suivants :
Tungstène : W ; or : Au ; magnésium : Mg ; hélium : He ; étain ; Sn.
Exercice 2.
Donner le nom des éléments associés aux symboles suivants :
Hg : mercure ; Na : sodium , Si ; silicium ; Sb : antimoine ; K : potassium.
Exercice 3.
Donner la formule semi-développée des composés suivants :
sulfate de cuivre : CuSO4 ( Cu2+ , SO42-) : bichromate de potassium : K2CrO4 ; chlorure d'ammonium : NH4Cl ;
méthanal : H2C=O ; triéthylamine : (CH3-CH2)3 N.
Exercice 4.
Indiquer l’état physique des composés suivants à la température 25 °C et sous la pression 1 bar :
hydroxyde de sodium : solise ; HCl : gaz : diiode : solide ; CH3COONa : solide ; Br2 : liquide.
Exercice 5.
Équilibrer les équations suivantes :
3C6H11-OH + Cr2O72- + 8H+ --> 3C6H10 O+ 2Cr3+ +7H2O.
Cr2O72- + 14H+ + 6e- --> 2Cr3+ +7H2O.
3 fois {C6H11-OH --->C6H10 O +2H+ + 2e- }.
2NH4Cl + Ca(OH)2 -->CaCl2 +2 H2O + 2NH3.
3Cl2 + 8NH4OH --> 6NH4Cl + 8H2O + N2.
3 fois {Cl2 +2e- -->2Cl- }
2NH4OH + 6HO- --> N2 + 6e- +8H2O.
Sb2S3+ 6HCl --> 2SbCl3 +3H2S.
CH3-CH2-CH3 +5O2 --> 3CO2 + 4H2O.
Exercice 6.
Sur l’étiquette d’un flacon d’acide nitrique, on peut lire les données suivantes :
densité : 1,41
HNO3 70%
masse molaire : 63 g/mol
Quelle est la concentration de cet acide ? Justifier la réponse.
Masse de 1 L : 1410 g.
Mase d'acide nitrique : 1410 x 0,70 =987 g.
Concentration : 987 / 63 = 15,67 ~15,7 mol / L.
Expliquer précisément, en indiquant le matériel à utiliser, comment
préparer 2 litres d’une solution d’acide nitrique de concentration 1,0
mole par litre à partir de ce flacon.
Facteur de dilution : 15,7 / 1,0 = 15,670,127 L..
Volume de solution commerciale à prélever : 2 / 15,67 ~0,128 L
Prélever 0,128 L de solution commerciale ( éprouvette graduée)
Dans une fiole jaugée de 2 L contenant 1/3 d'eau distillée, verser ce prélevement.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Bouger et agiter pour rendre homogène.
Exercice 7.
Légender le montage ci-dessous :
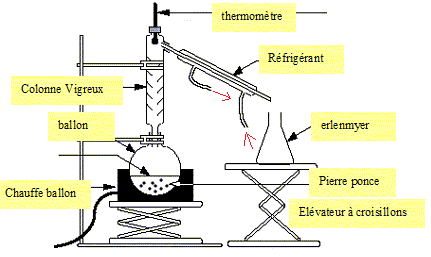
Exercice 8.
Dessiner et légender un montage de « chauffage à reflux » :
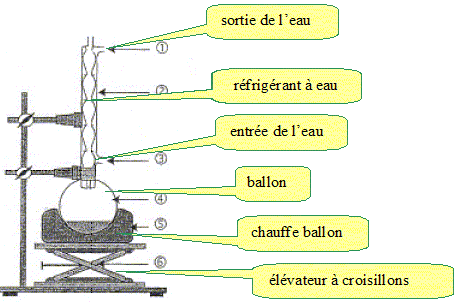
Exercice 9.
Les esters sont des composés
organiques, souvent à l’origine de l’arôme naturel des fruits. À côté
de leur production naturelle, ils sont aussi synthétisés pour
satisfaire les besoins de l’industrie agroalimentaire, de la parfumerie
et d’autres secteurs industriels. Le butanoate d’éthyle est, par
exemple, un ester à l’odeur d’ananas, l’éthanoate de propyle rappelle
l’odeur de la poire.
Compléter l’équation ci-dessous et nommer les produits formés lors d’une réaction d’estérification :
RCOOH + R'OH--> RCOOR' + H2O.
Nom des produits : ester + eau.
Indiquer, en complétant le
tableau suivant, les paramètres ayant une influence sur la vitesse de
réaction et le rendement d’une réaction d’estérification :
|
Augmente la vitesse de réaction
|
Augmente le rendement
|
Chauffage à reflux
|
vrai ( la température est un facteur cinétique )
|
non
|
Ajout d'un acide
|
vrai
|
|
Ajout d'une base
|
|
|
Ajout d'eau
|
|
|
Augmentation de la pression
|
|
|
Ajout d'un excès de R'OH
|
vrai
|
vrai
|
Nommer et donner la formule
semi-développée des deux réactifs conduisant à la formation de
l’éthanoate de butyle (arôme de banane) :
Acide éthtanoïque CH3--COOH et butan-1-ol CH3-CH2-CH2-CH2OH.
En analysant l’environnement chimique de chaque groupe de protons
équivalents de l’éthanoate de butyle, indiquer la multiplicité des
signaux provenant des atomes d’hydrogène portés par les différents
atomes de carbone lors d’une analyse RMN proton.
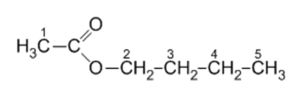
| carbone 1 : 3 protons
équivalents |
aucun proton portés par le
carbone voisin
|
singulet
|
| carbone 2 : 2 protons
équivalents |
couplage avec deux protons
portés par le carbone voisin
|
triplet
|
| carbone 3 : 2 protons
équivalents |
couplage avec deux protons
portés par un carbone voisin
et couplage avec deux protons différents portés par l'autre carbone
voisin |
multiplicité = (n1+1)(n2+1)
= 3*3 = 9
|
| carbone 4 : 2 protons
équivalents |
couplage avec deux protons
portés par un carbone voisin
et couplage avec trois protons différents portés par l'autre carbone
voisin
|
multiplicité = (n1+1)(n2+1)
= 3*4 = 12 |
| carbone 5 : 3 protons
équivalents |
couplage avec deux protons
portés par le carbone voisin
|
triplet
|
|
...
|
....
|
2. HYGIÈNE ET SÉCURITÉ.
Exercice 1.
Parmi la liste suivante, quels produits chimiques ne sont plus utilisés en collège et en lycée :
plomb solide, sodium solide, sulfate de cuivre anhydre solide, benzène, acide chlorhydrique dilué, nitrate d’argent, étain solide, solution de dichromate de potassium, butanol ?
Produits interdits en lycée : benzène, formol et mercure.
Parmi la liste suivante, quels produits chimiques est-on amené à
trouver dans un institut technologique post-bac : plomb solide, sodium solide, sulfate de cuivre, anhydre solide, benzène, acide chlorhydrique dilué, nitrate d’argent, étain solide, solution de dichromate de potassium, butanol ?
Exercice 2.
Lorsqu’on achète de l’acide chlorhydrique dans le commerce, on peut lire les indications suivantes :

Quelle(s) précaution(s) d’utilisation faut-il adopter ? Justifier la réponse.
Que signifient H et P ?
H : mention de danger et P mention de prudence.
Provoque de graves brûlures de la peau et des lésions des yeux. peut irriter les voies respiratoires.
Port de blouse, gants et lunettes ; travail sous hotte.
Le produit est-il plus dense que l’eau ? Est-il plus dense que l’air ?
d = 1,18 > 1. Il est plus dense que l'eau et plus dense que l'air.
Dans quel état se trouve-t-il si on le verse à l’air libre dans un bécher ? Justifier la réponse.
Etat liquide : Tébullition = 110 °c et Tfusion = -30 °C.
Exercice 3.
Donner la signification des abréviations suivantes :
FDS : fiche de données de sécurité.
EPI : équipement de protection individuelle.
CMR : cancèrigène, mutagène, reprotoxique.
Exercice 4.
Un élève s’est renversé une solution d’acide chlorhydrique concentré sur le bras. Une brûlure apparaît. Que doit-on faire ?
Rincez la peau à l'eau tiède pendant au moins 30 minutes. Une visite chez le médecin sera nécessaire.
Exercice 5.
Compléter le tableau suivant en vue d’un recyclage de substances chimiques (choix multiples possibles) :
sulfate de cuivre 0,50 mol.L−1 :métaux
chlorure de sodium 0,01 mol.L−1 : évier.
acide chlorhydrique 5,0 mol.L−1 : acides.
chlorobenzène : solvants halogénés.
desTop : bases
butanol : autres solvants organiques.
vinaigre 10° : évier, acides.
Exercice 6.
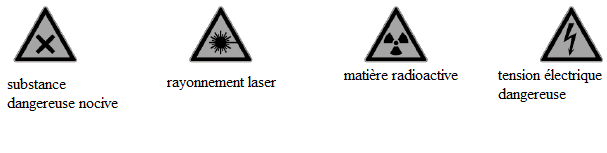
En salle de TP de Chimie, on trouve les pictogrammes suivants :
Que signifient-ils ?

Exercice 7.
On demande au préparateur en chimie de manipuler un produit qu’il ne
connaît pas. Où peut-il trouver rapidement les renseignements sur sa
dangerosité ?
Fiche de donnée sécurité, brochure INRS.
Exercice 8.
À la fin d’un TP en électricité, la majorité des multimètres ne
fonctionne plus. L’enseignant dit que ses élèves ont fait des mesures
d’intensité du courant. Quel(s) conseil(s) peut-on alors donner au
professeur ?
Vérifier les fusibles, une surintensité a pu les détruire..
Exercice 9.
Lors d’un TP sur la diffraction de la lumière, un élève est ébloui par
le faisceau laser de classe 1. Le professeur paniqué ne sait pas ce
qu’il faut faire. Comment peut-on aider l’enseignant ?
Laser sans danger pendant leur utilisation, même en cas de vision directe dans le faisceau sur une longue période.
Voici des pictogrammes que l’on peut rencontrer en salle de TP :
Quel(s) pictogramme(s) faut-il afficher lors d’un TP dans lequel on utilise un laser de classe 2 ?
Donner la signification des autres pictogrammes.
Exercice 10.
Un enseignant de physique envoie le mail suivant au préparateur de son laboratoire :
« Bonjour, Je souhaite faire la semaine prochaine une séance de travaux
pratiques sur la mesure de la célérité des ultrasons. Le Conseil
d’Administration de l’établissement a donné son accord pour la mise en
place des TP. Pour rappel, la classe est divisée en deux groupes de 12
élèves. La salle a une surface de 70 m2 et contient 12 paillasses.
Pourriez-vous me donner des conseils pour que mes élèves puissent tous
réaliser l’expérience, dans le contexte de la crise liée au COVID-19 ? »
Rédiger la réponse au professeur.
Port du masque ; un groupe d'élèves par paillasse; distance d'un mètre entre les élèves; aérer fréquemment la salle.
3. PHYSIQUE – MATHÉMATIQUES – INFORMATIQUE
Exercice 1.
Donner le nom de l’instrument qui permet de mesurer la valeur d'un champ magnétique :
Teslamètre.
Lister le matériel d’une expérience qui permet d'obtenir une figure d'interférence :
Source lumineuse, fentes d'Young, écran.
Donner le nom de l’instrument qui mesure une grandeur exprimée en Décibel :
Sonomètre.
Quel instrument permet de visualiser si un objet est électriquement chargé ?
Electroscope.
Exercice 2.
Donner le nom des objets suivants que l’on peut trouver dans un laboratoire de physique :


Exercice 3.
Compléter le tableau.
Symbole
|
Grandeur physique
|
nom de l'unité S.I
|
Symbole de l'unité S.I
|
R
|
résistance électrique
|
ohm
|
W
|
n
|
fréquence
|
hertz
|
Hz
|
P
|
pression
|
pascal
|
Pa
|
d
µ ou r
|
densité
masse volumique
|
kilograme par mètre cube
|
kg m-3
|
Exercice 4.
Compléter les expressions suivantes, avec un symbole mathématique de comparaison ( >, < ou =) :
0,52 L= 520 cm3 > 52 cm3.
3,5 m3 =3 500 L > 350 L
25 °C = 273 +25 =298 K < 318 K
8,4 mL =8,4 cm3.
7 × 10–8 m = 70 10-9 m = 70 nm
7 × 10–8 m= 0,07 10-6 m=0,07 µm < 0,7 μm.
Exercice 5.
Un préparateur dispose d'un budget de 5000 € pour acheter un nouvel appareil.
Celui-ci coûte 4900 euros HT, la TVA vaut 20%.
Calculer le prix TTC de l'appareil, en justifiant la démarche.
TVA : 4900 x0,20 =980 €.
Prix TTC : 4900 +980 =5 880 €.
Le fournisseur lui accorde une remise de 15%. Calculer le prix TTC de l'appareil avec la remise :
Cela rentre-t-il dans le budget ? Justifier la réponse.
Remise : 4900 x0,15 =735 €.
prix avec remise : 4900 -735 =4 165 €.
TVA : 4 165 x0,20=833 €.
Total : 4165 +833 =4 998 €.
Cela rentre dans le budget.
Exercice 6.
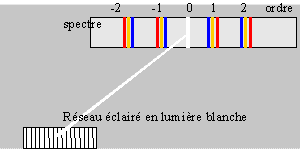
Proposer une liste de matériel permettant de réaliser une expérience
montrant la décomposition de la lumière blanche par un prisme :
Faire un schéma du dispositif du montage optique :
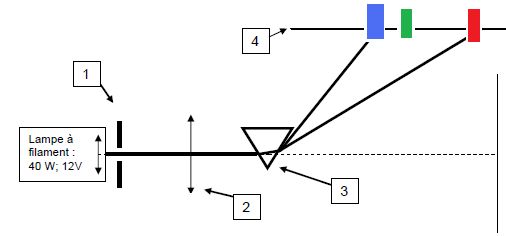
1 : fente fine ; 2 : lentille convergent ; 3 : prisme ; 4 : écran.
Ou encore :
Exercice 7.
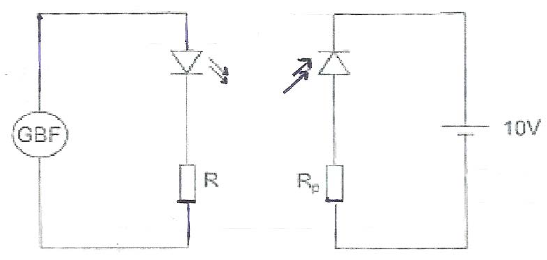
Un adjoint de laboratoire souhaite tester les plaquettes émettrice et
réceptrice infrarouge qu'il vient de retrouver dans un tiroir. Il
réalise le montage ci-dessus. Donner les noms des composants et
appareils électrique qu’il doit utiliser.
Source de lumière ( lampe), ampèremètre en série et voltmètre en dérivation.
Exercice 8.
Indiquer la fonction remplie par les logiciels ou applications suivants :
PowerPoint : création diaporama.
Internet Explorer :navigateur internet.
ChemDraw : éditeur moléculaire.
Adobe Acrobat Reader : convertir, modifier des fichiers PDF.
Word : traitement de texte.
Que signifient les lettres dans ExAO ?
expérience assistée par ordinateur.
|
|