|
chlorure de sulfuryle ; chlorocyclohexane ; pentaoxyde de diazote ; dismutation des ions hypochlorites En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
A 270 °C, le chlorure de sulfuryle SO2Cl2 noté A se dissocie totalement selon l’équation bilan SO2Cl2 (g)= S02 (g) + Cl2 (g) Tous les constituants sont gazeux et assimilés à des gaz parfaits.
v= -dPA/dt = k PA ; dPA/PA= -k dt puis intégrer ln PA = -kt + Cte La constante est déterminée à partir des conditions initiales : à t=0 , lnP0=Cte ln PA = -kt + lnP0 ; ln (PA/P0 ) = -kt
additionner (1) et (2) : 2 n = (PA+P)V/(RT) et en tenant compte de (3) : 2P0V/(RT) = (PA+P)V/(RT) ; 2P0 =PA+P ; PA= 2P0 -P.
à t= t½ alors PA=½P0 soit PA/P0 =0,5 or ln (PA/P0 ) = -kt, d'où : ln 0,5 = -ln 2 = -k t½. t½ = 1/(k ln 2)=1/(1,6 10-3*ln2)=902 min. k= cte exp(-Ea/(RT)) ou ln k = ln Cte -Ea/(RT) ln k1 = ln Cte -Ea/(RT1) (4); ln k2 = ln Cte -Ea/(RT2) (5) soustraire (4)-(5) : ln k1 - ln k2 = ln (k1/ k2)= Ea/R ( 1/T2-1/T1) avec ln (k1/ k2) = ln(t½2/ t½1 ) ; Ea= R ln(t½2/ t½1 ) / ( 1/T2-1/T1) ln(t½2/ t½1 ) = ln(4,21/187)=-3,8 ; T1 = 273+280 = 553 K ; T2 = 273 + 330 = 603 K Ea= 2 105 J. d[SO2Cl*]/dt = k1[SO2CL2]-k2[SO2Cl*]+ k3 [SO2CL2] [Cl*]-k4[SO2Cl*][Cl*]=0 (1) d[Cl*]/dt =k1[SO2CL2]+k2[SO2Cl*]- k3 [SO2CL2] [Cl*]-k4[SO2Cl*][Cl*]=0 (2) (1) + (2) donnent : 2k1[SO2CL2] =2k4 [SO2Cl*][Cl*] soit [SO2Cl*] = k1[SO2CL2] /(k4[Cl*]) (3) (1) - (2) donnent : 2k2[SO2Cl*]=2 k3 [SO2CL2] [Cl*] soit [SO2Cl*] = k3 [SO2CL2] [Cl*] / k2 (4) (3) et (4) donnent : [Cl*] ² = k1k2/(k3k4) vitesse de la réaction : d[SO2CL2]/dt = -k1[SO2CL2]- k3 [SO2CL2] [Cl*] puis remplacer (Cl*) par son expression ci-dessus d[SO2CL2]/dt = -[SO2CL2]( k1 +k3 (k1k2/(k3k4))½)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le chlorure d’hydrogène (B) réagit sur le cyclohexène (A) avec formation de chlorocyclohexane (C), selon la réaction : C6H10 + HCl --> C6H11Cl schématisé par : A +B -->C On réalise une série d’expériences à 25°C, où l’on mesure la vitesse initiale v0 de la réaction en fonction des concentrations molaires initiales [A]0 en cyclohexène et [B]0 en chlorure d’hydrogène dans le milieu réactionnel. Les diverses espèces sont dans un solvant approprié et le volume réactionnel est constant et égal à 1 litre. Les résultats sont rassemblés dans le tableau ci dessous :
corrigé v= k[A]p [B]q.
[B]0 est multipliée par 0,328/0,235 = 1,4 ( proche de racine carrée de deux) ;or la vitesse v0 double: en conséquence q=2 expériences 2 et 3 : [A]0 constant [B]0 est multipliée par 0,448/0,328 = 1,36 ( remarque : 1,36 ²=1,86) ; or la vitesse v0 est multipliée par 1,86 : en conséquence q=2. expériences 3 et 4 : [B]0 constant [A]0 est multipliée 0,313/0,47 = 0,66 et la vitesse v0 est aussi multipliée par 0,66 : en conséquence p=1 ordre global p+q=3 dx/dt = k(a-x)3 avec a = 0,47mol/L et x avancement en mol. dx/(a-x)3 = kdt intégrer : une primitive de 1/(a-x)3 est 2/(a-x)² + constante 2/(a-x)² =kt + cte à t=0 , x=0 et cte = 2/a² 2/(a-x)² -2/a²=kt à t½ alors x = 0,5 a 8/a²-2/a²=k t½. t½.= 6/(ka²)=6/(6,05 10-7 *0,47²)= 4,5 107 s.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le pentaoxyde de diazote N2O5 gazeux se transforme par chauffage dans un récipient de volume constant en dioxyde d'azote NO2 et dioxygène O2.
corrigé cinétique d'ordre 1 ( N2O5 est noté A): v= -dPA/dt = k PA ; dPA/PA= -k dt puis intégrer ln PA = -kt + Cte La constante est déterminée à partir des conditions initiales : à t=0 , lnP0=Cte ln PA = -kt + lnP0 ; ln (PA/P0 ) = -kt
k= 3 10-2 min -1. Les intermédiaires réactionnels restent en quantité pratiquement constante et très faible. d[Pintermédiaire] / dt =0 N2O5 = NO2
+NO3 k1, k2 d PN2O5/dt = -k1PN2O5 + k2PNO2 PNO3 - k4 PNOPN2O5 (1) d PNO/dt = 0 = k3 PNO2 PNO3- k4 PNOPN2O5 k3 PNO2 PNO3= k4 PNOPN2O5 (2) dPNO3 /dt = 0 = k1PN2O5 - k2PNO2 PNO3- k3 PNO2 PNO3=k1PN2O5 -( k2+k3)PNO2 PNO3 k1PN2O5 =( k2+k3)PNO2 PNO3 (3) (3) donne PNO2 PNO3 = k1/( k2+k3) PN2O5 repport dans (1) d PN2O5/dt = -k1PN2O5 + k2k1/( k2+k3) PN2O5 - k4 PNOPN2O5 (4) et en tenant compte de (2) et de (3) : k4 PNOPN2O5 =k3 k1/( k2+k3)PN2O5 repport dans (4) d PN2O5/dt = -k1PN2O5 + k2k1/( k2+k3) PN2O5 - k3 k1/( k2+k3)PN2O5 d PN2O5/dt = -k1( 1-k2/( k2+k3)+ k3 /( k2+k3))PN2O5. k= -k1( 1+ ( k3-k2)/( k2+k3)). Le dioxyde d'azote marqué 15 NO2 apparaît dans chaque étape élémentaire et cet isotope de l'azote est stable. L' azote 15 N peut donc être utilisé comme traceur et permet de déterminer les quantités de chaque espèce.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Dans le domaine de pH où la réaction 2 Fe3+ (aq) + 2 I- (aq) -> 2 Fe2+ (aq) + I2 (aq) est totale, on se propose de décrire sa cinétique. Des résultats expérimentaux ont permis de proposer la décomposition en actes élémentaires (toutes les espèces sont en solution). Fe3+ + I- --> FeI2+ k1 FeI2+ --> Fe3+ + I- k2 FeI2+ + I- --> Fe2+ + I2- k3 Fe3+ + I2- --> Fe2+ + I2 k4 FeI2+ et I2- sont des intermédiaires très instables et très réactifs pour lesquels on pourra faire l'approximation de l'état stationnaire.
corrigé d[FeI2+] / dt = k1[Fe3+][I-]-k2[FeI2+]-k3[FeI2+][I-]=0 k1[Fe3+][I-]-[FeI2+](k2+k3[I-])=0 (1). d[I2-] / dt=k3[FeI2+][I-] - k4[I2-][Fe3+]=0 (2). d[Fe3+]/dt = -k1[Fe3+][I-] + k2[FeI2+]- k4[I2-][Fe3+] (3) (1) +(2)+(3)donne : d[Fe3+]/dt = - 2k4[I2-][Fe3+] (4) (1) donne : [FeI2+]= k1[Fe3+][I-] / (k2+k3[I-]) repport dans (2) : k3k1[Fe3+][I-]2 / (k2+k3[I-])- k4[I2-][Fe3+]=0 k3k1[I-]2 / (k2+k3[I-])- k4[I2-]=0 k4[I2-]=k3k1[I-]2 / (k2+k3[I-]) repport dans (4) :d[Fe3+]/dt = - 2k3k1[Fe3+][I-]2 / (k2+k3[I-]) on peut négliger k2 devant k3[I-] : d[Fe3+]/dt = - 2k1[Fe3+][I-] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On étudie la cinétique de la formation du complexe [Co(NH3)5OH]2+ [Co(NH3)5Cl]2+ + OH- <=> [Co(NH3)4NH2Cl]+ + H2O (k1 et k-1) noté A +OH-<=> B + H2O [Co(NH3)4NH2Cl]+ ---> [Co(NH3)4NH2]2+ + Cl- (k2) noté B -->C + Cl- [Co(NH3)4NH2]2+ + H2O ---> [Co(NH3)5OH]2+ noté C + H2O ---> D
corrigé [Co(NH3)5OH]2+ : pentaamminohydroxocobalt (III) [Co(NH3)5Cl]2+ : pentaamminochlorocobalt (III) A +OH-<=> B + H2O (k1 et k-1) B -->C + Cl- (k2) C + H2O ---> D (k3) La somme des trois équations donne : A= D d[B] / dt =k1[A][OH-] - k-1[B][H2O]-k2[B]=0 k1[A][OH-] -[B](k-1[H2O]+k2)=0 (1) d[C]/dt = k2[B]- k3[C][H2O]=0 (2) d[D]/dt = k3[C][H2O](3) (2) + (3) donne : d[D]/dt =k2[B] (4) (1) donne : [B]= k1[A][OH-] / (k-1[H2O]+k2) repport dans (4) : d[D]/dt =k2 k1[A][OH-] / (k-1[H2O]+k2) si k2 est petit devant k-1. [H2O] : d[D]/dt =k1 k2[A][OH-] / (k-1[H2O]) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
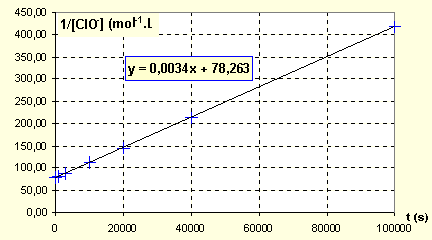
Partie 1: A température suffisamment élevée, les ions hypochlorite ClO- peuvent se dismuter selon la réaction totale: ClO- --> 1/3 ClO3- + 2/3 Cl- La vitesse de disparition des ions ClO- suit une loi cinétique de second ordre.
Partie 2 :Méthode d'isolement d'Ostwald: En solution alcaline, l'ion hypochlorite se dismute suivant la réaction: 3 ClO- ---> ClO3- + Cl- On mesure la concentration de ClO- en fonction du temps dans deux solutions différentes : 1ère solution : [ClO-]0 = 1,27 .10-2 mol/L et [OH-]0 = 0,26 mol/L
corrigé équation de vitesse : d[ClO-] / dt = - k [ClO-] 2 ; soit a la concentration initiale en ion hypochlorite ; à la date t, la concentration est a-x; soitd[ClO-] / dt = -dx/dt dx/dt = k ( a-x)2 ; dx/ (a-x)²= k dt intégration : 1/(a-x) = kt + constante la constante est déterminer par les conditions initiales : 1/a = 0 + constante 1/(a-x)-1/a = kt
ou 1/[ClO-]-1/[ClO-]0=
kt.
1/[ClO-]0 = 1/0,1 = 10 ; [ClO-] = 0,7*0,1 = 0,03 ; 1/[ClO-] =1/0,07 = 14,28 ; k= 0,0031 mol.L-1.s-1. t= 1/0,0031*(14,28-10)= 1380 s. ln( k'/k)= Ea/R(1/T-1/T') = 47 103 /8,31[1/343-1/363]=0,877. k'/k = 2,4 soit k'= 2,4*0,0031 =7,45 10-3 mol.L-1.s-1. La disparition de 30 % des ions ClO- est obtenu à : 1/[ClO-]0 = 1/0,1 = 10 ; [ClO-] = 0,7*0,1 = 0,03 ; 1/[ClO-] =1/0,07 = 14,28 ; k= 7,45 10-3 mol.L-1.s-1. t= 1/7,45 10-3*(14,28-10)=
574 s.
v = kapp[ClO-]q avec kapp = k.[OH-]p dans l'hypothèse d'un second ordre :1/ [ClO-]0 = 1/ 1,27 .10-2 = 78,7.
kapp= 3,3 10-3 = k [OH-]0p = 0,26p k.
même travail pour la seconde expérience :1/ [ClO-]0 = 1/ 2,71 .10-2 = 36,9.
la température des deux séries de mesures étant la même, alors k est constant. de plus kapp est le même dans les deux cas, alors que [OH-]0 a changé : donc p=0. La concentration des ions hydroxydes n'a pas d'influence sur la vitesse de la réaction |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|