|
Dosage pHmétrique d'une solution d'acide phosphorique. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
|
|||
|
|
Données (à 25 °C) : pK1 (H3PO4 / H2PO4-) = 2,1 ; pK2 (H2PO4- / HPO42-) = 7,2 ; pK3 (HPO42- / PO43- ) = 12,4 ; Produit ionique de l’eau à 25 °C : pKe = 14,0
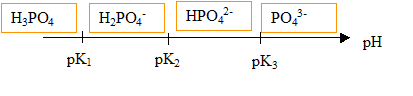
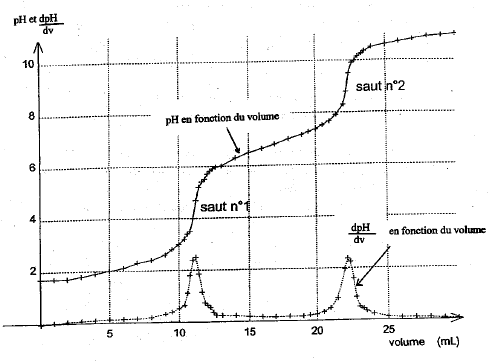
Le pH de la solution (S) est de 2,1, égal à pK1. Les espèces majoritaires issues de l'acide phosphorique dans (S) sont H3PO4 et H2PO4-, en quantités égales. Le coefficient de dissociation de l'acide phosphorique dans (S) est donc 50%. Étude de la première équivalence : l'espèce majoritaire est H2PO4- au point E1. cette espèce est un ampholyte, elle se comporte comme un acide ou comme une base. H2PO4- + H2O = HPO42-+ H3O+ ( comportement acide) K2 = [HPO42-][H3O+] / [H2PO4-] (1) H2PO4- +H3O+ = H3PO4 + H2O ( comportement basique) expression littérale du pH à la première équivalence E1 : pH= ½(pK1+pK2) = 0,5(2,1+7,2)=4,65. équation de la réaction de dosage entre E1 et E2 : H2PO4- +HO- = HPO42-+ H2O avec KR= [HPO42-]/ ([H2PO4-][HO-] ) (2) en tenant compte de (1) : KR=K2 / ([H3O+][HO-] ) = K2 / Ke = 10-7,2 / 10-14 = 106,8 = 6,3 106. Cette constante étant grande, la réaction est totale. Étude de la deuxième équivalence : espèce majoritaire qui impose le pH à la deuxième équivalence E2 : HPO42- pH2= ½(pK2+pK3) = 0,5(7,2+12,4)=9,8. équation de la réaction de dosage après la deuxième équivalence : HPO42- +HO- = PO43-+ H2O avec KR= [PO43-]/ ([HPO42-][HO-] ) (2) or HPO42- + H2O = PO43-+ H3O+ avec K3 = [PO43-][H3O+] / [HPO42- ] (3) en tenant compte de (3) : KR=K3 / ([H3O+][HO-] ) = K3 / Ke = 10-12,4 / 10-14 = 101,6 = 39,8. Cette constante étant assez faible, la réaction est partielle. Le saut de pH correspondant au dosage de la 3è acidité est faible : on ne peut pas doser la 3è acidité de l'acide phosphorique par suivi pHmétrique.
|
||
|
Concentration de la solution d'hydroxyde de sodium cB= 1,25 10-1 mol/L.
corrigé 
Les 10 mL de la prise sont prélevés à la pipette jaugée + pipeteur
saut 1 : H3PO4 + HO- = H2PO4- + H2O saut 2 : H2PO4- + HO- = HPO42- + H2O au premier saut de pH: Vequi = 24,3 / 2 = 12,15 mL Vs [acide phosphorique]= Vequi[soude] soit [acide phosphorique] = 12,15*0,125/10 = 0,152 mol/L masse molaire H3PO4 : M = 3+31+64 = 98g/mol ; 0,152*98 = 14,9 g/L. On peut réaliser un dosage colorimétrique avant de réaliser le dosage pHmétrique. La zone de virage de l'indicateur coloré doit contenir la valeur du pH au point équivalent . pour repérer le premier saut (pH voisin de 4) : vert de bromocrésol , hélianthine pour repérer le second saut (pH voisin de 9) : phénolphaléine
|
|||
|
|