|
concours inspection des fraudes En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
| .
. |
||
|
||
|
|
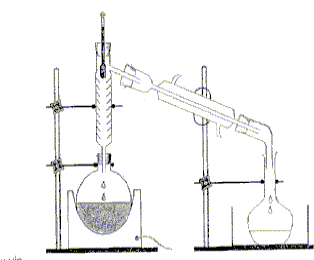
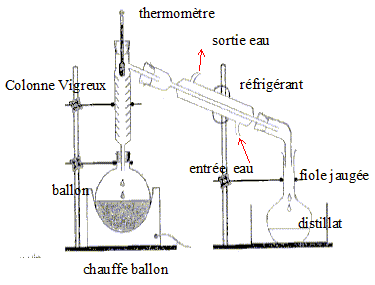
On distille E0 = 20,00 mL de cet apéritif additionné de 100 mL d’eau. Le distillat est recueilli dans une fiole jaugée de U = 250,0 mL. Lorsqu’on a 60 mL de distillat qui contient alors tout l’éthanol de la boisson alcoolisée, on complète avec de l’eau jusqu’au trait de jauge : soit S la solution obtenue.
DONNÉES M du sel de Mohr = 392,16 g.mol -1 ; M de l’éthanol = 46,0 g.mol -1 ; Masse volumique de l’éthanol à 20°C = 789 kg.m-3 Potentiels redox des couples CH3COOH / C2H5OH = 0.05 V ; Cr2O72- / Cr3+ = 1,36 V ; Fe3+ / Fe2+ = 0,77 V E(électrode au calomel à KCl saturé) / (électrode standard à hydrogène) = 0,245 V
préparation de l’essai (E) : 3 fois { C2H5OH +H2O = CH3COOH + 4H+ + 4e- } oxydation alcool 2 fois { Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7 H2O } réduction de l'ion dichromate 3C2H5OH + 2Cr2O72- +16H+= 3CH3COOH + 4Cr3+ + 11 H2O (1) dosage du témoin (T) : 6 fois { Fe2+ = Fe3+ +e- } oxydation de l'ion fer II Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7 H2O Cr2O72- +6Fe2+ +14H+ = 6Fe3++ 2Cr3+ + 7 H2O (2) rôle de l’acide sulfurique : les ions oxonium H3O+ noté H+ ci-dessus, sont l'un des réactifs concentration C en ions fer (II) de la solution de sel de Mohr préparée : n(mol) = m (g)/ Mg/mol) = 20,98 / 392,16 = 5,35 10-2 mol C(mol/L) = n(mol) / V (L) = 5,35 10-2 /0,1 = 0,535 mol/L. nombre de moles de dichromate de potassium utilisés dans l’essai (E) et le témoin (T): d'après les coefficients de l'équation (2) : n( Fe2+ ) = 6 n(dichromate) n(dichromate) = 6 E2 C2 avec C2 : concentration en ion dichromate n( Fe2+ ) = CVE ( pour l'essai) et n( Fe2+ ) = CVT ( pour le témoin) essai : 6 n(dichromate) = CVE ; n(dichromate) = CVE /6 = 0,535*8,65 10-3 /6 = 7,71 10-4 mol de dichromate en excès témoin : n(dichromate) = CVT /6 = 0,535*23 10-3 /6 = 2,05 10-3 mol nombre de moles de dichromate de potassium ayant réagi lors de la préparation de l’essai (E) : CVT /6 -CVE /6 =(2,05-0,771) 10-3 = 1,279 10-3 mol nombre de moles d’éthanol dans la prise d’essai E1 : d'après les coefficients de l'équation (1) : n( alcool ) = 1,5 n(dichromate ayant réagi)= 1,5*1,279 10-3 = 1,918 10-3 mol titre alcoométrique de l’apéritif analysé : masse d'alcool dans 10 mL de S : m(g) = n(mol) * M(alcool) (g/mol) = 1,918 10-3 *46 =8,83 10-2 g volume d'alcool : m(g) / masse volumique (g/mL) = 8,83 10-2 /0,789 = 0,112 mL dans 10 mL de la prise donc 25*1,12=2,8 mL d'alcool pur dans 250 mL de S ou encore dans 20 mL d'apéritif soit 2,8*5 = 14 mL d'alcool pur dans 100 mL d'apéritif. ( 14°) les électrodes à utiliser : une électrode de référence (électrode au calomel à KCl saturé) et une électode de mesure ( graphite ou platine ) plongeant dans la solution. avant l'équivalence, les ions dichromate sont en excès, le couple Cr2O72- / Cr3+ fixe le potentiel de l'électrode de mesure : Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7 H2O E= 1,36 + 0,01 log ([Cr2O72-][H+]14/[Cr3+]2) après l'équivalence, les ions fer II sont en excès, le couple Fe3+ / Fe2+ fixe le potentiel de l'électrode de mesure : E = 0,77 + 0,06 log ([Fe3+]/[Fe2+])
|
|
|
|