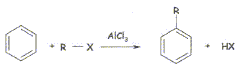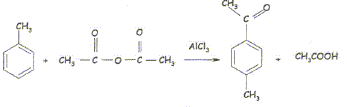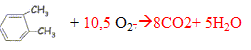|
Sécurité.
- Donner le nom des pictogrammes représentés ci-dessous
:
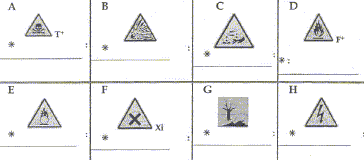
A : très toxique ; B
risque d'explosion ; C : corrosif ; D : matières inflammables
E : matières comburantes ; F : matières nocives ou irritantes ; G :
dangers pour l'environnement ; H : danger électrique.
- Un étudiant reçoit une projection d'hydroxyde de
sodium dans l'oeil. Que faites-vous ? Classer par priorité votre ou vos
interventions.
- Vous signalez immédiatement l'accident à l'enseignant.(2)
- Vous neutralisez avec de l'acide.
- Vous rincez l'oeil abondamment à l'eau (1).
- Vous conseillez à l'étudiant de voir un ophtalmologiste.(3)
- Vous attendez que l'enseignant responsable des TP intervienne.
- Vous devez réaliser une réaction de Friedel et Crafts
: elle consiste à fixer une chaîne latérale hydrocarbonée sur un arène
à l'aide d'un halogènure d'alkyle, appelé encore halogénoalcane R-X (
ou X est soit Cl ou Br), en présence d'un catalyseur, AlCl3.
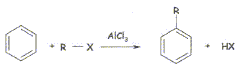
L'acylation de Friedel et Crafts est la méthode la
plus importante de préparation des cétones aromatiques. La réaction
envisagée est la préparation de la 4-méthylacétophénone.
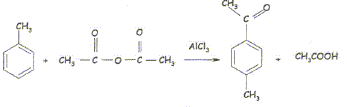
Durant cette réaction un dégagement gazeux de
chlorure d'hydrogène se produit, il faudra donc le piéger. Une partie
du mode opératoire est décrit ci-dessous.
Mode opératoire : dans un ballon tricol de
100 mL muni d'une agitation, d'une ampoule à brome à tubulure latérale
permettant l'équilibration de la pression et d'un réfrigérant relié à
un système piègean, placer 169 mmol de AlCl3
anhydre, recouvrer avec 358 mmol de toluène anhydre.
- Verser dans l'ampoule à brome 75 mmol d'anhydride acétique.
- Placer le ballon dans un bain d'huile, réglez une agitation aussi
élévée que possible et ajoutez, goutte à goutte,l'anhydride acétique.
L'addition devra durer de 15 à 20 min. Durant celle-ci, le dégagement
sera très visible. Lorsque l'addition est terminée, chauffez le ballon
entre 90 et 100 °C pendant 30 min, vérifiez que le dégagement gazeux
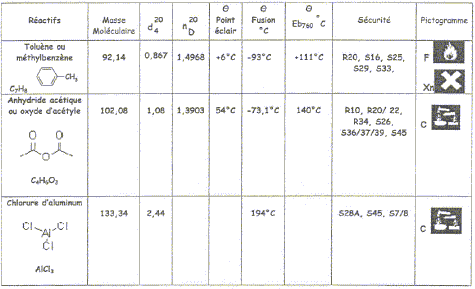
est terminé. Le tableau ci-dessous donne les caractéristiques
physico-chimiques des réactifs nécessaires.
- Quelles précautions prenez-vous pour effectuer cette manipulation ? blouse, gants, lunettes de protection,
travaiiler en absence de flammes, travail sous hotte aspirante les
produits étant nocifs, corrosifs, ou inflammables.
- Sachant que le milieu de cette réaction doit-être anhydre, quel
matériel utilsez-vous ?colonne
désséchante
- Quel produit utilisez-vous, dans le piège, pour neutraliser le
chlorure d'hydrogène gazeux ? soude.
Comment vérifiez-vous, à la fin de la réaction, qu'il n'y a plus de
dégagement gazeux ?
- Calculer en masse ( g) et le volume ( quand il s'agit de liquides )
des réactifss nécessaires à cette synthèse, donnez le détails des
calculs.
toluène
: liquide d= 0,867 ; n= 0,358 mmol ; M= 92,14 g/mol
m=nM=0,358*92,14 = 33 g
volume ( mL) = masse (g) /densité = 33/0,867 = 38 mL.
anhydride acétique : liquide d = 1,08 ; M=
102,08 g/mol ; n=0,075 mol
m=nM=0,075*102,08 = 7,66 g ; V= m/d = 7,66/1,08 =7,1 mL.
AlCl3 : solide
M=133,34 g/mol ; n= 0,169 mol
m= nM= 0,169*133,34 = 22,5 g.
|
|
Préparation
de solution :
Vous avez à préparer 0,1 L d'une solution d'acide
chlorhydrique 1,5 mol/L à partir d'un acide concentré. H : 1 ; Cl :
35,5 g/mol ; masse volumique 1,17 kg/L ; % massique : 37%.
- Quel volume d'acide chlorhydrique concentré
allez-vous prélever ? Préciser le calcul.
masse de 1L : 1,17 kg =
1170 g ; masse d'acide pur dans 1 L : 1170*0,37 = 432,9 g
quantité de matière (mol) dans 1 L = masse (g) / masse molaire (g/mol)
= 432,9/36,5 = 11,86 mol dans 1L.
facteur de
dilution F= concentration mère / concentration fille = 11,86 / 1,5 = 7,9
Volume de solution mère à prélever : volume fiole jaugée / F = 0,1 /
7,9 = 0,0126 L = 12,6 mL.
Indiquer le protocole, ainsi que les précautions à prendre.
L'acide concentré est
corrosif : port de blouse, gants, lunette de protection ; travail sous
hotte.
Prélever 12,6 mL de la solution mère à l'aide d'une pipette graduée +
pipeteur.
Placer dans la fiole jaugée de 100 mL contenant 2/3 d'eau distillée.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
|
|
Réactions
chimiques
Compléter et équilibrer :
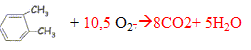
Ba(OH)2 +2
CH3COOH ---> Ba(CH3COO)2
+ 2H2O.
Br2+2KOH--->KBrO+ KBr + H2O.
Al + 3HCl
---> AlCl3 + 1,5H2(g)
Al4C3 + 12 H2O
--->4 Al(OH)3
+3 CH4
(g)
2 FeS2
+5,5 O2
---> Fe2O3 + 4 SO2 (g)
CH3-CH2-OH
+ Na---> CH3-CH2-ONa
+ ½H2 ( alcoolate de sodium + dihydrogène).
A + H2O--> C+ base ( A est un acide ; C est H3O+
+ la base conjuguée de l'acide A)
|
|
Connaissances
générales :
Physique :
Vous devez installer une nouvelle étuve. Sur son
étiquette sont portées les indications 230 volts ; 2800 watts ; 50/60
Hz.
- Calculer l'intensité corespondant à cet appareil. I= P/U = 2800/230 = 12,2 A.
- Donner la couleur du fil : de terre ( jaune
verre) ; du neutre (bleu)
de la phase ( autre couleur que le
bleu ou le jaune-vert)
- Cette étuve a coûté 1500 euros TTC. La TVA est de 19,6 % et le
fournisseur a consenti une remise de 10 %. Calculer le pris HT.
prix HT diminué de la remise
de 10 % : 1500/1,196 =
1254,18 euros
prix HT avant remise
: 1254,18 / 0,9 = 1393,53 euros.
Gestion
:
Il vous est demandé
de passer la commande des réactifs nécessaires à la réaction de Friedel
et Crafts. Cette manipulation sera effectuée 4 fois. Dans le catalogue
des produits vous trouvez pour chacun des trois produits, plusieirs
qualités, conditionnement et prix HT, données ci-dessous :
Toluène anhydre
conservé sur tamis moléculaire : 1L au prix de 26,06 euros ; 2,5 L au
prix de 58,00 euros.
Toluène pur à 98 % :
1L au prix de 12,23 euros ; 2,5 L au prix de 23,49 euros.
Anhydride acétique
ultra-pur : 500 mL au prix de 14,36 euros ; 1L au prix de 36,80 euros.
Anhydride acétique
pur à 96 % : 500 mL au prix de 12,70 euros ; 1L au prix de 22,70 euros.
Chlorure d'aluminium
anhydre en poudre pur à 99,999% : 10 g au prix de 32,10 euros ; 20 g au
prix de 51,60 euros.
Chlorure d'aluminium
anhydre en poudre pur à 98,5% : 100 g au prix de 15,50 euros ; 500 g au
prix de 47,00 euros.
Indiquez pour chaque
produit la qualité choisie et la quantité qu'il faut commander.
Calculer le montant
HT pour chaque produit et le montant de la facture ( TVA à 19,6 %)
|
désignation
|
prix unitaire HT
|
quantité
|
prix total HT
|
justifier le choix
|
|
toluène anhydre
|
58,00
|
0,358*4 =1,43 L ( 2,5 L)
|
58,00
|
le prix de 2 fois 1L est supérieur à celui de
2,5 L
|
|
anhydride acétique
|
14,36
|
38*4 = 152 mL ( 500 mL)
|
14,36
|
produit pur sans trace d'eau
|
|
chlorure d'aluminium anhydre
|
15,50
|
22,5*4 = 90 g ( 100 g)
|
15,50
|
catalyseur anhydre
|
|
|
total HT
|
87,86
|
|
|
|
TVA ( 19,6%)
|
17,22
|
|
|
|
total TTC
|
105,08
|
|
|