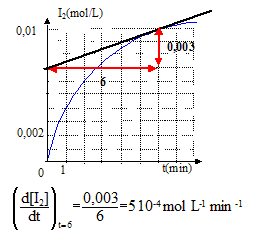|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||
| .
. |
||
|
||
|
|
l'équation bilan est : H2O2 + 2I- +2H3O+= 4H2O+I2.
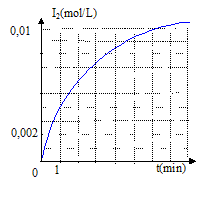
2I- =I2 + 2e- oxydation H2O2 +2e- +2H3O+= 4H2O réduction l'équation bilan de la réaction : H2O2 + 2I- +2H3O+= 4H2O+I2. refroidir le tube avant le dosage du diiode : on réalise un blocage cinétique. Quantités de matière initiales : n0(H2O2)= V1 [H2O2] = 4*0,2 = 0,8 mmol n0(H3O+)= V3 [H3O+] = 1*1 = 1 mmol ; n0(I-)= V2 [I-] =5*0,1 = 0,5 mmol à partir de 0,8 mmol d'eau oxygénée il faut 1,6 mmol d'ion iodure et 1,6 mmol d'ion oxonium : or on ne dispose que de 0,5mmol d'ion iodure ; ce dernier est en défaut et constitue le réactif limitant. concentration en diiode dans un tube à la fin de la réaction : nf(I2 ) = ½n0(I-)= 0,25 mmol volume total du mélange : 4+5+1 = 10 mL ; [I2]f = 0,25/10= 2,5 10-2 mol/L Cette valeur n'est pas atteinte ( sur le graphe on lit à t= 6 min , [I2]f =10-2 mol/L) ; la réaction n'est pas encore terminée. rendement de la réaction en diiode formé à t = 6 min : concentration réelle / concentration thèorique *100 = 0,01 / 0,025 *100 = 40% vitesse de formation du diiode : 1/V dx/dt = d[I2]/dt avec V : volume du mélange réactionnel et x avancement (mol) valeur de la vitesse de formaton du diiode à la date t= 6 min
|
|
|
|