|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
|
corrigé H2O2 = H2O +½ O2(g) concentration d'une solution de peroxyde d'hydrogène à 130 volumes : quantité de matière O2(mol) = volume (L) / volume molaire (L/mol) = 130/22,4 =5,8 mol d'après les coefficients de l'équation ci-dessus, la quantité de matière (mol) de peroxyde d'hydrogène est égale à deux fois celle de dioxygène : 5,8*2 = 11,6 mol dans 1 L. autre méthode : masse de peroxyde d'hydrogène pur dans 1 L : 1,13*1000*0,33 = 372,9 g Qté de matière (mol) = masse (g) / masse molaire (g/mol) = 372,9 / 34,01 = 10,96 mol dans 1 L écart relatif voisin de 6% : résultats identiques à 6% près. L'eau oxygénée en vente en pharmacie est une solution à 6% et de densité 1,02 : n(H2O2) = 1020*0,06 / 34,01 = 1,8 mol dans 1L d'après les coefficients de l'équation ci-dessus n(O2 ) =½ n(H2O2) = 0,9 mol volume (L) = Qté de matière (mol) * volume molaire (L/mol) = 0,9*22,4 = 20 volumes.
|
|||||||||||||||||||||||
conservation de l'élément carbone : [CH3COOH] +[CH3COO-]=C0d'où [CH3COOH] =C0(1-a) Ka = (a C0)² / (C0(1-a)) = C0a²/(1-a) Calcul de a si C0 = 0,1 mol/L : pKa = 4,75 soit Ka =1,78 10-5 ; 1,78 10-5(1-a) = 0,1a². 0,1a²+1,78 10-5a -1,78 10-5 = 0 ; la résolution donne a = 1,32 10-2. volume d'eau faut à ajouter à 1 L de solution aqueuse d'acide éthanoïque pour que a double : Ka = C0a²/(1-a) = C(2a)²/(1-2a) soit C0(1-2a) = 4C (1-a) ; C= C0(1-2a)/(4(1-a)) = 0,1*0,9736/(4*0,9868) = 2,446 10-2 mol/L facteur de dilution : f = C0/C = 0,1/ 2,446 10-2 = 4,05 f = volume total / volume solution mère soit volume total = 4,05*1 = 4,05 L ; il faut ajouter 3,05 L d'eau à 1L de la solution mère de concentration C0. volume d'acide éthanoïque pur à ajouter à 1 L de solution aqueuse d'acide éthanoïque pour que a soit divisé par 2 : ( même méthode) Ka = C0a²/(1-a) = C'(0,5a)²/(1-0,5a) soit C0(1-0,5a) = 0,25C' (1-a) ; C'= C0(1-0,5a)/(0,25(1-a)) = 0,4*0,9934/0,9868 =0,403 mol/L soit 0,403 mol d'acide dans 1 L : il a fallu ajouter 0,403-0,1 = 0,303 mol d'acide pur. soit en masse m 0,303*60,05 = 18,2 g ou encore 18,2 / d= 18,2/1,05 = 17,3 mL.
|
||||||||||||||||||||||||
corrigé le cuivre n'est pas attaqué par les ions oxonium : le résidu est du cuivre ( 3,2 g) On note mZn, la masse de zinc et mAl la masse d'aluminium : mZn + mAl = 14,1-3,2 = 10,9 (1) Qté de matière (mol) : nZn = mZn/ 65,39 ; nAl = mAl/ 26,98 ; (1) s'écrit : 65,39 nZn + 26,98 nAl =10,9 (1' ) Zn + 2 H+ = Zn2+ + H2(g) ; n(H2)1 = nZn. Al+ 3 H+ = Al3+ + 1,5 H2(g) ; n(H2)2 =1,5 nAl Qté de matière totale H2 : nZn + 1,5 nAl = 6,8 / 22,4 = 0,304 (2) (2) donne nZn = 0,304- 1,5 nAl ; repport dans (1') : 65,39(0,304- 1,5 nAl ) + 26,98 nAl =10,9 d'où : nAl =0,126 mol soit 0,126*26,98 = 3,41 g et nZn =0,115 mol soit 0,115*65,4 = 7,49 g.
2Fe3+
+Fe = 3Fe2+
si Fe3+en défaut 0,05-2xmax = 0 soit xmax =2,5 10-2 mol (retenir la plus petite valeur) [Fe3+]= 2,85 10-2 / 0,5 = 5,7 10-2 mol/L ; [Fe2+] = 6,44 10-2 mol/L masse minimale de poudre de fer à ajouter pour qu'il n'y ait plus d'ion Fe3+ : 0,05-2xmax =0 soit xmax = 0,025 mol n( Fe) = 0,025 mol soit en masse 0,025*55,85 = 1,4 g.
|
||||||||||||||||||||||||
corrigé pH d'une solution d'acide chlorhydrique HCl : pH= - log C = -log 3 10-4 = 3,5 Quant à la solution à 10-7 mol/L, il s'agit d'eau pure et non une solution acide ou de soude. ( pH=7) pH d'une solution de soude : pH= 14 + log C = 14 + log 3 10-4 =10,5. pH d'une solution d'acide fluorrhydrique HF à 0,1 mol/L : pH= ½(pKa-log C) = 0,5(3,2+1) = 2,1.
|
||||||||||||||||||||||||
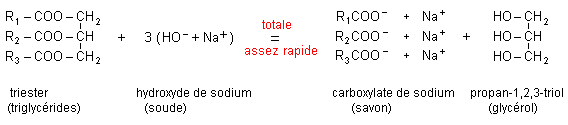
corrigé huile : matières grasses à l'état liquide à température ambiante, non miscibles à l'eau. graisse : lubrifiant composé d'une ou de plusieurs huiles , corps gras, mélange d'huiles. Un corps gras renferme une ou plusieurs fonctions ester. un acide gras est un acide carboxylique possédant une longue chaine carbonée hydrophobe, saturée ou insaturée. un savon ( ou carboxylate de sodium ou de potassium) est une substance solide utilisée le lavage ou le nettoyage. réaction de formation du savon à partir d'un corps gras : saponification.
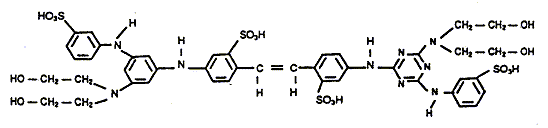
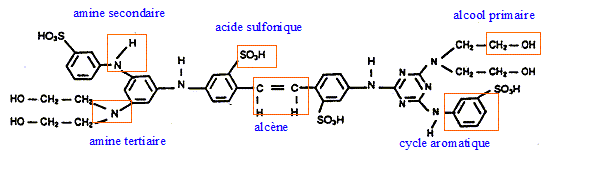
principales fonctions de la chimie organique présentes dans la formule du produit suivant :
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||
|
La réaction de l'ammoniac en excès sur un hydrocarbure saturé acyclique bromé A conduit à la formation d'une amine B, suivant une réaction de substitution électrophile. Dans B, le pourcentage massique en azote est égal à 1,27 fois le pourcentage massique en hydrogène.
corrigé formule brute de B : CnH2n+3 N ; masse molaire de B : M= 12n+2n+3+14 = 14 n+17 g/mol on note :%H = x d'où : %N = 1,27 x et %C = 100-2,27x. puis 12 n / (100-2,27x) =(2n+3)/x = 14/(1,27x) = (14n+17)/100 14/(1,27x) =11/x ; (2n+3)/x = 11/x soit 2n+3=11 ; n= 4 ; C4H11N. nom et la formule semi-développée de B sachant que la chaine hydrocarbonée est linéaire : CH3-CH2-CH2-CH2-NH2 butylamine ( amine primaire) formule semi-développée et le nom des diverses amines isomères, de classe différente : CH3-CH2-CHNH2-CH3 1-méthylpropylamine ( amine primaire) CH3-CH2-CH2-NH-CH3 ( amine secondaire) N-méthylpropylamine CH3-CH2-N(CH3)2 ( amine tertiaire) N,N- diméthyléthylamine. formule brute, le nom et la formule semi-développée de A : C4H9Br. CH3-CH2-CH2-CH2-Br : 1-bromobutane.
|
||||||||||||||||||||||||
|
|
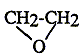 acétone
; ether éthylique ; oxyde
d'éthylène ; éthanol.
acétone
; ether éthylique ; oxyde
d'éthylène ; éthanol.