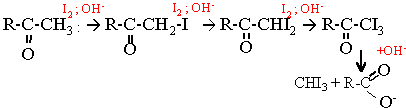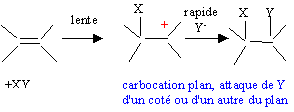|
CAPES physique chimie ( concours interne 2005 ) Composés iodés en chimie organique. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||
| .
. |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|
Soit la séquence réactionnelle suivante : (1) A (CxHyOz)----> B + C ( qui précipite) [ deux étapes : 1 : -HO- puis 2 : + I2 en excès] (2) A ----> D (C4H10O) en présence NaBH4--->E ( milieu acide à chaud)---> F( en présence I-Cl)
corrigé Formule brute de A : CxHyOz. Les pourcentages massiques en carbone, hydrogène et oxygène sont respectivement : 66,7 % ; 11,1 % ; 100-66,7-11,1 = 22,2 % 12 x / 66,7 = y/11,1 / 16 z/22,2 = 0,72 d'où x= 4 ; y= 8 ; z = 1 d'où C4H8O. Le spectre RMN présente les signaux suivants : d=1,2 ppm, triplet ( donc deux protons proches voisins), intégration : 3H -C(=O)- CH2-CH3; d=2,5 ppm, quadruplet ( donc trois protons proches voisins), intégration : 2H -C(=O)- CH2-CH3 d=2,2 ppm, singulet, intégration : 3H -C(=O)- CH3. Formule
semi-développée pour A : CH3-C(=O)-CH2-CH3.
butan-2-one ou butanone.
C test est caractéristique des cétones possédant un groupement méthyle en a du groupement fonctionnel, groupe carbonyle >C=O. Les trois atomes d'hydrogène du groupe méthyle sont substitués successivement par des atomes d'iode. Le composé tri-iodé perd facilement l'iodoforme CHI3 ; celui -ci précipite. Il se forme de plus un ion carboxylate.
La cétone a iodée est plus réactive que la cétone elle même. CH3-CH2 -CO-CH3 + 3I2 + 4OH- --> CH3-CH2 -COO- + CHI3 solide + 3I- + 3H2O
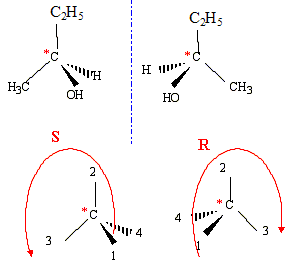
L'hydrogénation catalytique de la butanone conduit à un alcool secondaire le butan-2-ol : CH3-CH2 -*CH(OH)-CH3 l'ordre de préséance est le suivant :( ordre de n° atomique décroissant) pour le carbone n°2 : -OH ; -CH3-CH2 ; -CH3 ; H on regarde dans la direction C*-->4 :
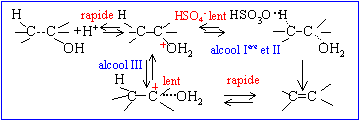
Les réactions de déshydratation suivent la règle de Zaïtsev : l’alcène le plus substitué se forme préférentiellement. ('intermédiaire de réaction, le carbocation secondaire CH3-CH2 -+CH-CH3 étant plus stable que le carbocation primaire)
Cette réaction est " stéréosélective " : elle conduit de façon préférentielle à l'isomère E plutôt qu' E'. E : but-2-ène CH3-CH=CH-CH3 ; E' : but-1-ène CH3-CH2-CH=CH2
La liaison est polarisée : d+I-Cld-.
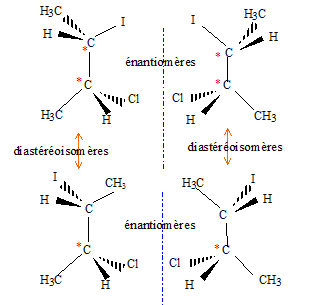
La seconde étape ( réaction entre le carbocation et l'ion chlorure nucléophile) s'effectue indifféremment d'un côté ou de l'autre de l'atome de carbone trigonal. La réaction n'est en conséquence pas stéréosélective. Le composé F présente deux atomes de carbone asymétriques : |
||||||||||||||||||||
|
|
|||||||||||||||||||||
|
|