|
Concours assistant d'ingénieur : RMN, spectro de masse 2004 ( Lille) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||
| .
. |
|||||||||||||||||||
|
|||||||||||||||||||
|
Exercice
1 :
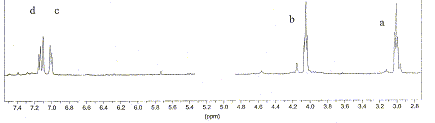
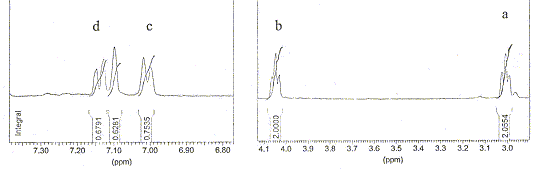
Le spectre RMN du proton est fourni ci-dessous. Les protons hydroxyliques sont échangeables et n'apparaissent pas sur le spectre.
Les hydrogènes échangeables ne sont pas liés de manière stable à une molécule ; ils sont en équilibre avec les hydrogènes du solvant. Les protons liés à des groupes amines et hydroxy sont des protons échangeables. Un pH trop élevé accélère l’échange des protons échangeables avec le solvant : le solvant utilisé a des propriètés basiques. La réaction correspondant à l'échange de protons hydroxyliques est une réaction acide base. Triplet à 3 ppm, ( la courbe d'intégration indique deux protons) : -CH2-F ( F noyau benzénique) Triplet à 4 ppm, ( la courbe d'intégration indique deux protons) : -CH2-OH. singulet à 7,1 ppm : proton aromatique sans proton en position a. Doublets à 7 ( en a du CH2-) et 7,2 ppm : deux protons aromatiques situés en a l'un de l'autre . donc structure C. Exercice
2 :
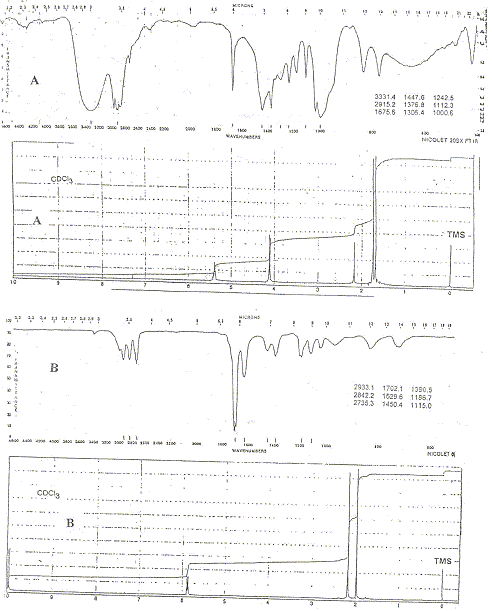
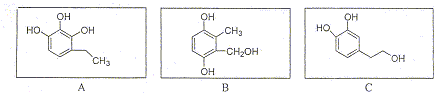
Proposer les structures de A et B. On donne les spectres IR et RMN. A : le spectre IR indique une large bande vers 3000 cm-1 ( fonction alcool), une absence de bande vers 1700 cm-1 ( pas de groupe >C=O) et un pic vers 1600 cm-1 ( liaison >C=C<) Le spectre RMN indique : un singulet à 2,2 ppm ( 1 proton) -OH alcool, un singulet à 4,1 ppm ( deux protons) -CH2-O, un singulet à 5,5 ppm ( 1 proton) C=CH alcène, deux singulets vers 1,7 ppm ( 2*3 protons ) deux groupes CH3 déblindés. HO-CH2-C(CH3)= CH-CH3. B : le spectre IR indique une bande vers 1700 cm-1 ( groupe >C=O) et un pic vers 1600 cm-1 ( liaison >C=C<) Le spectre RMN indique : un singulet à 10 ppm ( 1 proton) -CHO aldehyde, un singulet à 6 ppm ( 1 proton) C=CH alcène , deux singulets vers 2 ppm ( 2*3 protons ) deux groupes CH3 déblindés. CHO-C(CH3)= CH-CH3. Oxydation d'un alcool primaire en aldehyde. Exercice
3 :
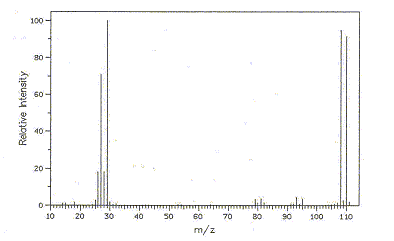
Les 2 pics à M et à M+2 ( 108 et 110) d'égale hauteur indique la présence d'un atome de brome. L'ion apparaissant à la masse m/e=108 correspond au pic moléculaire dont le rapport m/e vaut 1. Il s'agit d'un radical cation (espèce portant un électron dépareillé et une charge positive, formé lors du choc d'un électron contre d'une molécule neutre ). pics à 79 et 81: Br. ; pic à 29 : CH3-CH2+. ; pic à 27 CH2=CH+. ;
Exercice
4 :
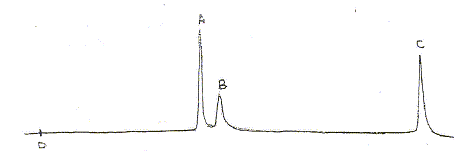
Une solution standard comprenant
trois composés A, B et C, tous trois à la
concentration c= 10 mg/L est analysée par
chromatographie liquide haute performance ( CLHP) dans les
conditions suivantes : colonne garnie de silice
greffée C18, phase mobile
eau/méthanol, débit : 0,9 mL/min, injection
par vanne avec boule de 20 mL,
détection dans l'UV à 254 nm. Le
chromatogramme obtenu est donné ci-dessous
:
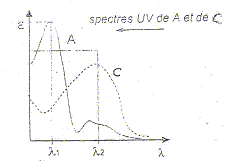
Il s'agit d'une chromatographie en phase inverse : colonne garnie de silice greffée C18, phase mobile eau/méthanol polaire Le "temps de rétention" :(temps au bout duquel un composé est élué de la colonne et détecté), caractéristique d'un composé pour une colonne et un éluant donnés. Classification des trois composés en fonction de leur polarité : La colonne apolaire retient le composé le moins polaire A qui sort donc en dernier ; le plus polaire C sort en premier. La résolution entre les pics A et B n'est pas très bonne ; entre B et C elle est bonne. Pour améliorer cette chromatographie on peut utiliser une phase mobile de polarité différente. Une prise d'essai de 100 mL d'un échantillon d'eau est extraite par un solvant organique. L'extrait est concentré à 10,0 mL. Cet extrait concentré est injecté dans les mêmes conditions opératoires. Le chromatogramme ne montre qu'un seul pic de temps de rétention 7,86 min : on identifie donc A. La surface du pic est
proportionnelle à la concentration du composé
: c =10*5817/6473=9 mg/L
Exercice
6:
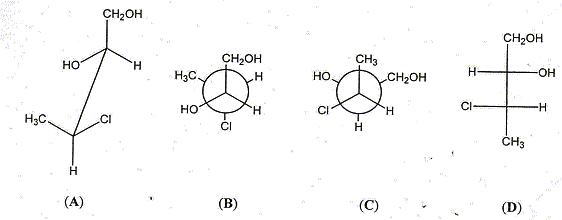
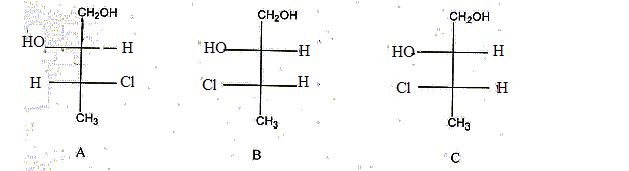
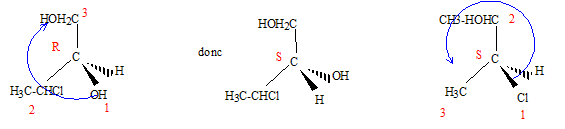
Représenter les composés A, B et C en représentation de Fischer. Quelle relation existe t-il entre les composés (A et D), (C et D), (A et B), (A et C), (B et C) ? Dans la représentation D, indiquer la configuration absolue des deux carbones asymétriques.
(A et D) : énantiomères ; (C et D) : diastéréoisomères ; (A et B) diastéréoisomères ; (A et C) diastéréoisomères ; (B et C) conformères. Dans la représentation D, le carbone porteur du groupe OH est dextrogyre (D), le carbone porteur du Cl est lévogyre (L): Ces deux atomes de carbone sont S( sinister)
|
|||||||||||||||||||
|
|
|||||||||||||||||||
|
|