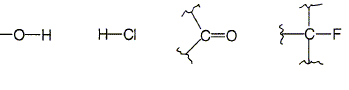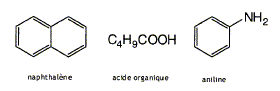|
concours technicien de recherche cnrs Chimie organique Alsace 2003 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||
| .
. |
||||||||
|
||||||||
|
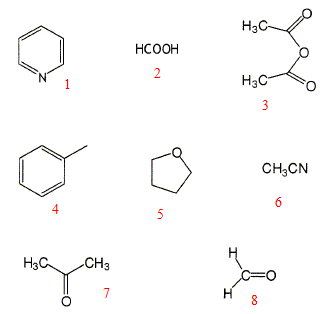
2 : acide formique ou
méthanoïque 3 : anhydride étahnoïque ou
acétique 4 : toluène 5 : tétrahydrofuranne 6 : acétonitrile 7 : acétone 8 : formaldehyde
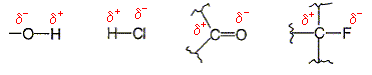
Donner la formule
semi-développée des groupements
suivants :
Quels traitements successifs simples permettent d'isoler chacun des constituants ? Passage en milieu basique : C4H9COOH passe sous forme d'ion C4H9COO- insoluble dans le chlorure de méthylène, beaucoup plus soluble dans l'eau. Puis extraction par solvants ( chlorure de méthylène - eau) Passage en milieu acide :
C6H5NH2 passe sous forme
d'ion C6H5NH3 +
insoluble dans le chlorure de méthylène,
beaucoup plus soluble dans l'eau. Puis extraction par
solvants ( chlorure de méthylène - eau)
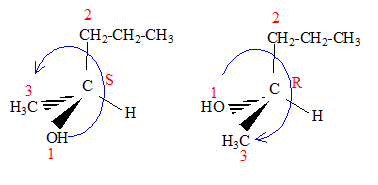
CH3-CH2-CH2-*CHOH-CH3. Un carbone asymétrique est un carbone tétragonal lié à 4 groupes différents. Dessiner les deux énantiomères en perspective et indiquer leur configuration absolue R ou S.
Pourrait-on différentier ces deux énantiomères par spectrométrie de masse ? Non, il se formera un ion ou un radical anion plan.
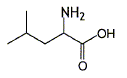
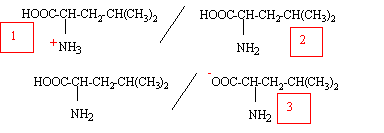
Quelle est sa formule brute ? [CH3]2CH-CH2CH NH2-COOH soit C6H13NO2. Quelle est sa masse molaire ? M= 6*12+13+14+32 =131 g/mol. On donne pour la leucine pKa1 = 2,36 ; pKa2 = 9,60. Représenter la forme majoritaire à pH=1 et à pH=12.
à pH=1 valeur inférieure à pKa1, la forme (1) prédomine ; à pH=12, valeur supérieure à pKa2, la forme (3) prédomine.
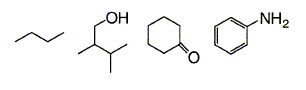
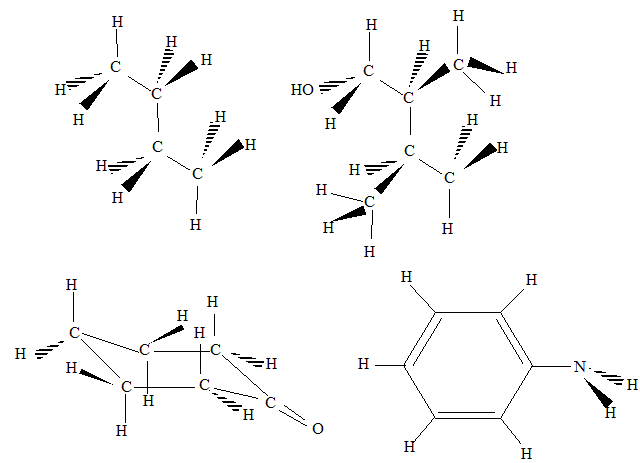
Dessiner la formule développée montrant tous les atomes des molécules suivantes :
|
||||||||
|
|
||||||||
|
|