|
synthèse de la langasite, dosage du sodium dans une poudre : absorption atomique concours technicien chimiste cnrs 2006 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
Vous possédez les produits de départ suivants : SiO2 ; Ga2O3 ; La2O3. Ecrivez et équilibrer ma réaction chimique. Calculer les masses molaires des oxydes de départ et de la langasite. La : 138,91 ; Ga : 69,72 ; Si : 28,086 ; O : 16 g/mol. Déterminer les masses des oxydes de départ
pour synthétiser 10 g de
langasite.
M(SiO2) =28,086 + 2*16 = 60,086 g/mol M(Ga2O3) =2*69,72 + 3*16 = 187,44 g/mol M(La2O3) = 2*138,91 + 3*16 = 325,82 g/mol M(La3Ga5SiO14) = 3*138,91 + 5*69,72 +28,086 +14*16 = 416,73 +348,6 + 28,086 +224 =1017,42 g/mol Quantité de matière de langasite (mol) = masse (g) / massemolaire (g/mol) n= 10/ 1017,42=9,83 10-3 mol.
On veut doser le sodium dans un élément de poudre pour absorption atomique. Pour cela on fait deux prélèvement, un de 4,0 mg et un de 9,8 mg. On leur fait subir une attaque avec 10 mL d'HCl de concentration 12 N. En fin de minéralisation, les solutions sont ajustées à 100 mL. Par ailleurs on effectue une courbe
d'étalonnage à l'aide de solutions de
concentrations connues. On effectue les mesures des
solutions connues et inconnues et on obtient les
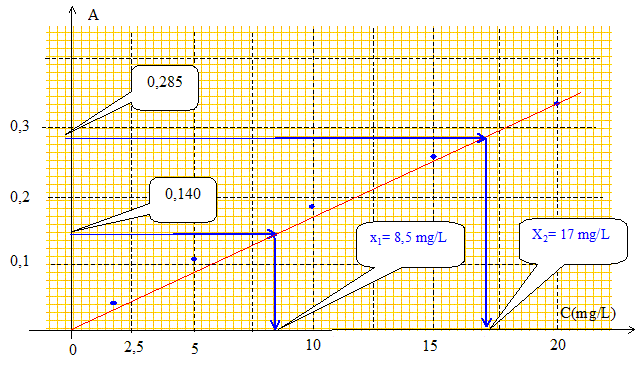
résultats suivants : Tracer la courbe d'étalonnage donnant la concentration en fonction de la densité optique. En déduire les concentrations x1 et x2. Calculer la teneur en sodium ( massique) dans la poudre de départ. La poudre subit une perte à "mille". Pour ce faire, 150 mg sont chauffés en capsule de platine à 1000 °C pendant 1 heure, puis sont refroidis en dessicateur : la pesée indique une masse de 133 mg. Quelle est la teneur exact en sodium sur produit calciné.
Le volume de la solution étant multiplié par 10, la concentration en acide chlorhydrique est divisée par 10 et devient 1,2 mol/L. Courbe d'étalonnage donnant la concentration en fonction de la densité optique :
Teneur en sodium ( massique) dans la poudre de départ : 0,85 mg dans 100 mL ou dans le prélevement de 4 mg soit : 0,85*100/4 = 21 %. 1,7 mg dans 100 mL ou dans le prélevement de 9,8 mg soit : 1,7 * 100 / 9,8 = 17 % Teneur moyenne 19 %. Teneur exacte en sodium sur produit calciné : Dans 150 mg initial il y a 150*0,19 = 28,5 mg de sodium. 28,5/133*100 = 21,4 %. |
||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
|
|