|
sécurité, acide formique, mélange d'acides orthophtalique et chlorhydrique concours itrf Lille 2001 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
Ils montrent que ce composé est une substance : - facilement inflammable ; irritante ; toxique ; comburante ; corrosive ; explosive. Donner la signification des panneaux d'avertissement et signalisation de risque ou de danger ci-dessous :
(1) matières radioactives, radiations ionisantes. (2) : rayonnement laser ; (3) : risque biologique. Donner les différentes voies de pénétration d'un toxique dans l'organisme : voie respiratoire ; bouche ; peau.
Une solution aqueuse d'acide formique A de concentration molaire c1 a un pH de 2,4. La constante d'acidité du couple HCOOH / HCOO- est Ka =1,58 10-4.
H : 1 ; Na : 23 ; O : 16 g/mol.
HCOOH + H2O = HCOO- + H3O+. Ka = [HCOO-][H3O+] / [HCOOH] (1) La solution est électriquement neutre et en milieu acide HO- est négligeable : [HCOO-]=[H3O+] (2) Conservation de l'élément carbone : [HCOOH] +[HCOO-] = c1. L'acide est peu dissocié, [HCOO-] négligeable devant [HCOOH] : [HCOOH] = c1. (1) s'écrit alors : Ka =[H3O+]2/c1 soit c1 = [H3O+]2/Ka avec [H3O+] = 10-pH = 10-2,4. c1 = 10-4,8 / 1,58 10-4 = 0,10 mol/L. pH d'une solution B de concentration 10-3 mol/L : [H3O+]2 = cB Ka = 10-3 *1,58 10-4 = 1,58 10-7 ; [H3O+]=3,97 10-4 mol/L ; pH = -log (3,97 10-4 ) ; pH=3,4. Lorsque la concentration de l'acide formique est divisée par 100, le pH n'augmente que d'une unité pH : l'acide formique est un acide faible. Coefficient de dissociation a de l'acide formique : a 1 = [HCOO-] / c1 = 10-2,4 / 10-1 = 10-1,4 = 0,04. a2 = [HCOO-] / cB = 10-3,4 / 10-3 = 10-0,4 = 0,4. Par dilution ( ajout d'eau) l'équilibre HCOOH + H2O = HCOO- + H3O+ est déplacé dans le sens direct, ionisation de l'acide formique. pH d'une solution contenant 0,1 mol/L d'acide formique et 0,1 mol/L d'acide chlorhydrique : On raisonne sur 1 L de solution ; l'acide chlorhydrique, acide fort apporte 0,1 mol d'ion oxonium ; l'acide formique apporte 10-2,4 =4 10-3 mol d'ion oxonium. n(H3O+) = 0,1 + 0,004 = 0,104 mol/L ; pH = - log 0,104 =0,98. Masse de soude solide à
ajouter à 600 mL de la solution A pour obtenir une
solution de pH égal à 4,1
: Le pH de la solution est donné par : pH = pKa + log ( [HCOO-] / [HCOOH]) avec pKa = -log 1,58 10-4 = 3,80 ; [HCOO-] / [HCOOH] = n/(0,06-n) et pH= 4,1. log ( [HCOO-] / [HCOOH]) = pH - pKa= 4,1-3,8 = 0,3 [HCOO-] / [HCOOH] = 100,3 =2 = n/(0,06-n) 2(0,06-n) = n ; n = 0,04 mol. Masse molaire de la soude NaOH = 23+16+1 = 40 g/mol masse (g) = masse molaire (g/mol) * quantité de matière (mol) =40*0,04 = 1,6 g. Volume d'eau à ajouter à 400 mL de la solution A pour obtenir une solution de concentration c3 = 0,625 c1 Le facteur de dilution est égal à F= c1/c3 = 1/0,625 =1,6. Le volume final sera égal à 400*1,6 = 640 mL : il faut ajouter 240 mL d'eau.
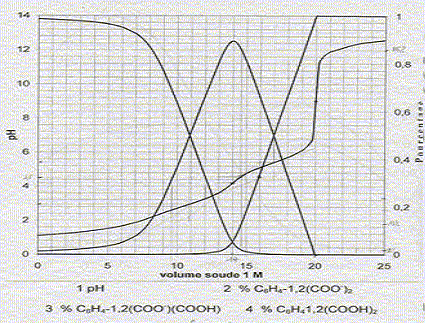
A 100 mL d'un mélange d'acide orthophtalique C6H4-1,2-(CO2H)2 et d'acide chlorhydrique, on ajoute progressivement 25 mL d'une solution de soude à 1 mol/L et on enregistre le pH et les pourcentages des différentes formes de l'acide orthophtalique.
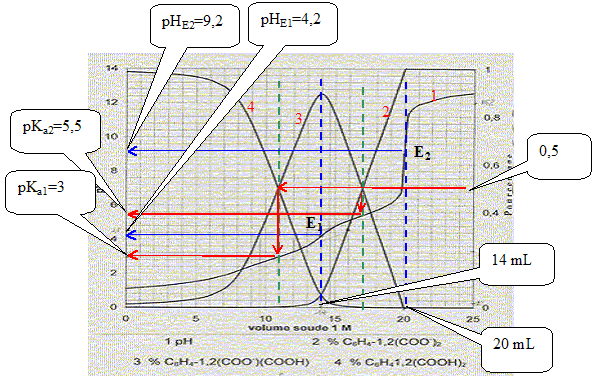
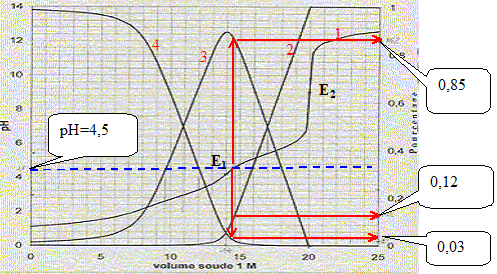
Equations dans l'ordre où elle vont se produire au cours du dosage : H3O+ + HO- = 2 H2O ; K1 = 1014. C6H4-1,2-(CO2H)2 + HO- = H2O + C6H4-1,2-(CO2-)(CO2H) K2 = 1014-pKa1 = 1011. C6H4-1,2-(CO2-)(CO2H) + HO- = H2O + C6H4-1,2-(CO2-)2 K3= 1014-pKa2 = 108,5. Le premier saut de pH correspond au dosage de HCl et de la première acicité de l'acide orthophtalique : à la première équivalence E1, la courbe 4 tend vers zéro. Le second saut correspond au dosage de la deuxième acidité de l'acide orthophtalique. Molarité de l'acide orthophtalique dans la solution de départ : Pour doser la seconde acidité il faut 20-14 = 6 mL de soude. Quantité de matière de soude (mol) = volume versé (mL) * concentration(mol/L) = 6 10-3*1 = 6 10-3 mol. d'où la concentration de l'acide orthophtalique : c2 = 6 10-3 /0,1 = 6 10-2 mol/L. Molarité de l'acide chlorhydrique dans la solution de départ : Pour doser l'acide chlorhydrique il faut 14-6 = 8 mL de soude. Quantité de matière de soude (mol) = volume versé (mL) * concentration(mol/L) = 8 10-3*1 = 8 10-3 mol. d'où la concentration de l'acide chlorhydrique : c1 = 8 10-3 /0,1 = 8 10-2 mol/L. Formule donnant le pH du premier saut : pHE1 =
½(pKa1 pKa2 ) = 0,5
(3+5,5) = 4,25, en
accord avec la valeur 4,2 lue sur le graphe. pH= ½(pKe+pKa2+log c2) = 0,5(14+5,5+log 0,06) = 9,15, en accord avec la valeur 9,2 lue sur le graphe. Concentration [H3O+] dans la solution de départ : d'après le graphe : pH est proche de 1 ; d'où [H3O+] = 0,1 mol/L. Pour pH=4,5 les pourcentages des diverses formes de l'acide orthophtalique sont :
|
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|