|
pile au lithium, solubilité oxalate de calcium, mélange phénol nitrobenzène et absorbance concours ITRF 2001 Lille En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
Couples oxydant / réducteur : Li+ / Li E°=-3,02 V ; I2/I- E°= 0,53 V. L'électrolyte utilisé est anhydre et la capacité utile de la pile est 1,8 Ah. L'intensité du courant est I= 100 mA et la masse de la pile est m = 23 g.
2Li =2 Li+ +2 e-. oxydation Le diiode se réduit à la cathode positive suivant : I2 + 2e- = 2I-. Bilan : 2Li +I2=2 Li+ + 2I-. Le courant circule dans le circuit extérieur en sens contraire des électrons : donc de la borne positive vers le lithium. La f.e.m de la pile vaut : 0,53-(-3,02) = 3,55 V. L'électrolyte doit être anhydre car le lithium réagit violemment avec l'eau. Autonomie de la pile : Q=It avec Q= 1,8 Ah, I= 10-4 A et t en heures. t = Q/I = 1,8 / 10-4 = 1,8 104 heures = 2,0 années. Masse de lithium et de diiode sont enfermés dans la pile pour obtenir cette autonomie : Quantité de matière d'électrons (mol) = Q ( coulomb) / 96500 = 1,8 *3600 / 96500 = 6,72 10-2 mol. Li = Li+ + e-. Donc n(Li) = n(e- ) = 6,72 10-2 mol. masse de lithium (g) = quantité de matière (mol) * masse molaire du lithium ( g/mol) = 6,72 10-2 *6,9 = 0,46 g. I2 + 2e- = 2I-. Donc n(I2) = 0,5 n(e- ) = 3,36 10-2 mol. masse de diiode (g) = quantité de matière (mol) * masse molaire du diiode ( g/mol) = 3,36 10-2 *(2*126,9) = 8,52 g. Vitesse de disparition du lithium en mol h-1 : 6,72 10-2 /1,8 104 =3,7 10-6 mol h-1.
On veut éliminer un calcul rénal constitué uniquement d'oxalate de calcium Ca(CO2)2. Sa masse est de 0,768 g. Le produit de solubilité à 37 °C de l'oxalate de calcium est Ks= 3,6 10-9 en exprimant les concentrations en mol/L. Quel serait le volume d'eau pure nécessaire pour dissoudre ce calcul ? Masse molaire Ca(CO2)2 : M= 40 + 2*(12+32) = 128 g/mol. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 0,768 / 128 = 6 10-3 mol. Ca(CO2)2 = Ca2+ + 2CO2-. Ks = [ Ca2+][CO2-]2 ; on pose s = [ Ca2+] ; [CO2-] = 2 [ Ca2+] = 2s. Ks = s (2s)2 = 4 s3. s3 = 0,25 Ks =0,25*3,6 10-9 = 9 10-10. s = 9,6 10-4 mol /L. Volume d'eau pure : 6
10-3 / 9,6 10-4 =
6,2
L.
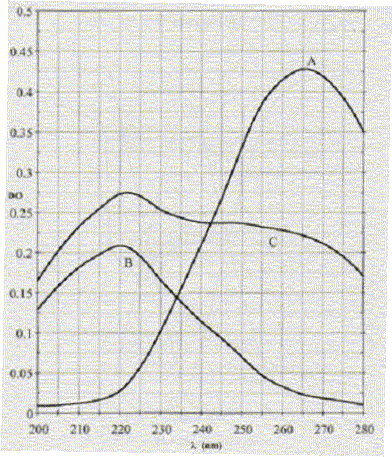
A : C6H5-OH : 188 mg dans 500 mL. B : C6H5-NO2 : 154 mg dans 500 mL. Les spectres sont représentés ci-dessous :
La solution C est un mélange inconnu de phénol et de nitrobenzène.
Masse molaire du phénol : M= 6*12+6+16 = 94 g/mol n= m/M = 0,188 / 94 = 2 10-3 mol. [phénol] =n/V =2 10-3/0,5 = 4 10-3 mol/L. Masse molaire du nitrobenzène : M= 6*12+5+14+32 = 123 g/mol n= m/M = 0,154 / 123 = 1,25 10-3 mol. [nitrobenzène] =n/V =1,25 10-3/0,5 = 2,5 10-3 mol/L. Coefficients d'extinction molaire du phénol et du nitrobenzène à l= 220 nm et 265 nm pour une cuve de 1 cm. A = e
c L avec c en mol
L-1, L en cm et e
en L mol-1 cm-1. A 220 nm, écrire que les densités optiques ou absorbances s'ajoutent : 0,275 = 6,25 c1 + 84 c2 (1). avec c1, concentration du phénol , c2 concentration du nitrobenzène dans C. A 265 nm, écrire que les densité optique ou absorbance s'ajoutent : 0,225 = 106,25 c1 + 10 c2 (2). Multiplier par 8,4 1,89 = 892,5 c1 + 84 c2 (2'). (2')-(1) donne : 1,665 = 886,25 c1 ; c1 = 1,88 10-3 mol/L. c2 = (0,275-6,25*1,88 10-3) / 84 = 3,13 10-3 mol/L. |
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||