|
degré
alcoolique d'un vin, dosage colorimétrique,
estérification concours
technicien chimiste 2002 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Pour déterminer le degré alcoolique d'un vin, on réalise l'expérience suivante. On soumet à distillation un mélange formé par une prise d'essai de 50 mL de vin, de la soude et de l'eau. On recueille les premiers 50 mL de distillat D. Dans ces conditions, le distillat contient la totalité de l'alcool du vin et les sustances autres que l'éthanol sont éliminées. Le distillat dilué 10 fois fournit la solution S. A 10 mL de S, on ajoute 25 mL d'une solution acide de dichromate de potassium 8,3 10-2 mol/L.
C : 12 ; H : 1 ; O : 16 g/mol ; masse volumique de l'éthanol r = 789 g/L. Couples redox : Cr2O72- / Cr3+ E° =1,33 V ; I2/I- E° =0,54 V ; S4O62- / S2O32- E°=0,08 V ; CH3COOH / CH3-CH2OH E° = 0,03 V. Equation bilan de l'oxydation de l'éthanol en acide éthanoïque : Réduction de l'ion dichromate : Cr2O72- +14 H+ +6e- =2 Cr3+ + 7H2O.(1) Oxydation de l'éthanol : CH3-CH2OH +H2O = CH3COOH +4 H+ +4e- (2) 2 fois (1) + 3 fois (2) donne : 2Cr2O72- +28 H+ +12e- +3CH3-CH2OH +3H2O =4 Cr3+ + 14 H2O+ 3CH3COOH +12 H+ +12e- 2Cr2O72- +16 H+ +3CH3-CH2OH = 4 Cr3+ + 11 H2O+ 3 CH3COOH. (4) Equation bilan de l'oxydation des ions iodures par le dichromate en milieu acide : Oxydation des ions iodures : 2I- = I2 + 2e- (3) (1) et 3 fois(3) donne : Cr2O72- +14 H+ +6e- +6I- =2 Cr3+ + 7H2O +3I2 + 26e- . Cr2O72- +14 H+ +6I- =2 Cr3+ + 7H2O +3I2 (5) Equation bilan du dosage du diiode par le thiosulfate de sodium : réduction du diiode : I2 + 2e- = 2I- oxydation de l'ion thiosulfate : 2S2O32- = S4O62- + 2e-. I2 + 2S2O32- = S4O62- + 2I-. Molarité de S puis de D : Quantité de matière de diiode libéré = 0,5 fois la quantité de matière de thiosulfate = 0,5* 0,5*11,2 10-3 = 2,8 10-3 mol. D'après (5) la quantité de matière dion dichromate en excès est égale à la quantité de matière de diiode divisée par 3 : n(Cr2O72- ) excès = 2,8 10-3 / 3 = 9,33 10-4 mol. Quantité de matière initiale d'ion dichromate : n0 = 25 10-3 * 8,3 10-2 = 2,08 10-3 mol. Quantité de matière d'ion dichromate ayant réagi avec l'éthanol : 2,08 10-3- 9,33 10-4 = 1,14 10-3 mol. D'après (4) la quantité de matière d'éthanol est égale à la quantité de matière d'ion dichromate multipliée par 1,5 : n(éthanol) = 1,5*1,14 10-3 = 1,71 10-3 mol dans 10 mL ou 0,01 L de S [éthanol]S = 1,71 10-3 /0,01 = 0,171 mol/L. [éthanol]D = 10 [éthanol]S =10*0,171 = 1,71 mol/L. Degré alcoométrique du vin sachant que celui-ci est égal au nombre de mL déthanol contenus dans 100 mL de vin : Masse d'éthanol dans 1 L (g) = quantité de matière (mol) * masse molaire (g/mol) M( éthanol) = 2*12+6+16 = 46 g/mol m = 1,71*46 = 78,7 g volume d'éthanol dans 1 L (mL) = masse (g) / masse volumique (g/mL) = 78,7 / 0,789 = 99,7 mL Degré = 10°C.
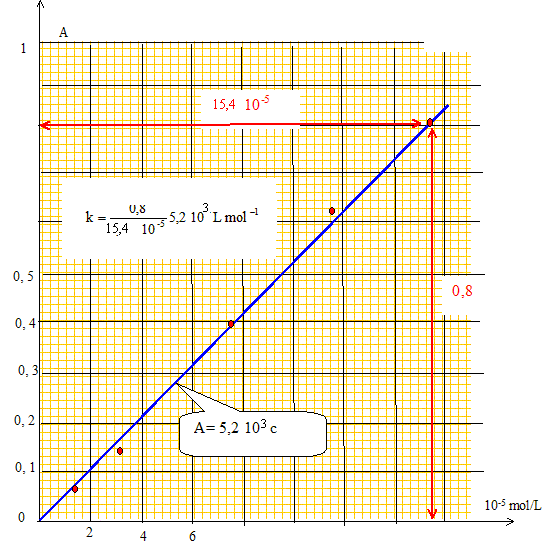
Question 6 : On désire doser par colorimétrie, un métal M présent dans un alliage contenant divers métaux. Pour ce faire, on réalise une gamme d'étalonnage à partir d'une solution mère A à 0,1 g/L de l'ion métallique M, en effectuant les dilutions suivantes : 100 mL de A dans 1000 mL ---> B 150 mL de B dans 200 mL ---> C 250 mL de B dans 500 mL ---> D 100 mL de D dans 250 mL---> E 10 mL de B dans 100 ml ---> F. Le dosage par colorimètrie,
à la longueur d'onde appropriée, des solutions
étalons donne les résultats suivants
:
Concentrations c en mol/L du métal M dans les solutions étalons : c0 =0,1 g /L soit 0,1/65 = 1,54 10-3 mol/L.
Concentrations, en mol/L, du métal M dans les solutions diluées :
titre massique : 1,96 10-3 *65 = 0,128 g/L = 128 mg/L. 12,8 mg dans 100 mL soit dans 100 mg d'alliage : 12,8 %.
CH3-COOH (A) + CH3-(CH2)3-CH2OH (B) = H2O (C) + D
D est un ester ( éthanoate de pentyle ) et la réaction est une estérification. A : acide éthanoïque ; B : pentan-1-ol. L'acide sulfurique joue le rôle de catalyseur ; il doit être concentré : la réaction étant équilibrée par l'hydrolyse de l'ester, la présence d'eau déplacerait l'équilibre vers la gauche. Pour manipuler cet acide, il faut porter une blouse, des gants et des lunettes de protection. En cas de projection sur la main, laver à grande eau. La pierre ponce régularise l'ébullition lors du chauffage à reflux.
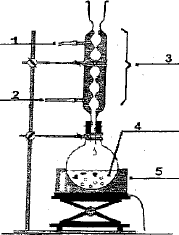
1 : sortie de l'eau ; 2 : arrivée de l'eau ; 3 : réfrigérant ou colonne Vigreux ; 4 : ballon ; 5 : chauffe ballon. Masses de A et B à utiliser pour obtenir 2 g de D : Masse molaire ( g/mol) : M(A) = 2*12+4+2*16 = 60 g/mol ; M(B) = 5*12+12+16 = 88 g/mol ; M(D) = 7*12+14+2*16= 130. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) n(ester) = 2 / 130 = 1,54 10-2 mol D'après les nombres stoechiométriques de la réaction : n(A) = n(B) = n(D)=1,54 10-2 mol Masse (g) = quantité de matière (mol) * masse molaire (g/mol) Puis diviser par 0,64 pour tenir compte du rendement : m(A) = 1,54 10-2 *60 /0,64=1,4 g ; m(B) = 1,54 10-2 *88 / 0,64 = 2,1 g. Volume de D : 2,1 / densité = 2,1 / 0,88 =2,4 mL. L'ester D peut être purifié par distillation.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|